15.11:
Determinazione del pH delle soluzioni saline
15.11:
Determinazione del pH delle soluzioni saline
Il pH di una soluzione salina è determinato dai suoi anioni e formazioni componenti. I sali che contengono anioni neutri dal pH e i uraci che producono ioni di idronio formano una soluzione con un pH inferiore a 7. Ad esempio, nella soluzione di nitrato di ammonio (NH4NO3),NO3− gli ioni non reagiscono con l’acqua mentre gli ioni NH4+ producono gli ioni di idronio con conseguente soluzione acida. Al contrario, i sali che contengono formazioni neutre in pH e gli anioni che producono ioni idrossido formano una soluzione con un pH maggiore di 7. Ad esempio, nella soluzione di fluoruro di sodio (NaF), il Na+ è neutro dal pH ma il F– produce gli ioni idrossido e forma la soluzione di base. Le controioni di un acido o di una base forte sono neutre in pH e i sali formati da tali controioni formano una soluzione neutra con un pH uguale a 7. Ad esempio, in KBr, lacatione K + è inerte e non influisce sul pH. Lo ione bromuro è la base coniugata di un acido forte, e quindi è di forza di base trascurabile (nessuna ionizzazione di base apprezzabile). La soluzione è neutra.
Alcuni sali contengono sia un catione acido che un anione di base. L’acidità o la basicità globale di una soluzione è determinata dalla forza relativa del catione e dell’anione, che può essere confrontata utilizzando Ka e Kb. Per esempio, in NH4F, lo ione NH4+ è acido e lo ione F− è fondamentale (base coniugata dell’acido debole HF). Confrontando le due costanti di ionizzazione: Ka di NH4+è 5,6 × 10−10 e il Kb di F −è 1,6 × 10−11, quindi la soluzione è acida, poiché Ka > Kb.
Calcolo del pH di una soluzione di sale acido
L’anilina è un’ammina che viene utilizzata per produrre coloranti. È isolato come cloruro di anilinio, [C6H5NH3+]Cl, un sale preparato dalla reazione dell’anilina di base debole e dell’acido cloridrico. Qual è il pH di una soluzione da 0,233 M di cloruro di anilinio?
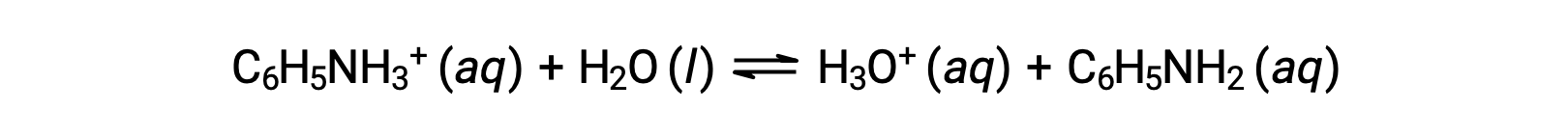
Il Ka per lo ione anilinio deriva dal Kb per la sua base coniugata, l’anilina:
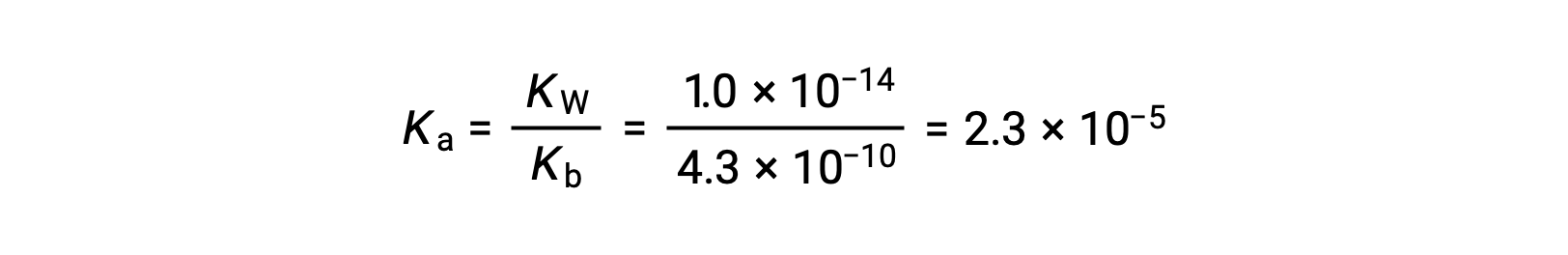
Utilizzando le informazioni fornite, viene preparata una tabella ICE per questo sistema:
| C6H5NH3+ (aq) | H3O+ (aq) | C6H5NH2 (aq) | |
| Concentrazione iniziale (M) | 0.233 | ~0 | 0 |
| Variazione (M) | −x | +x | +x |
| Concentrazione di equilibrio (M) | 0,233 − x | X | X |
Sostituendo questi termini di concentrazione di equilibrio nel Kun’espressione dà
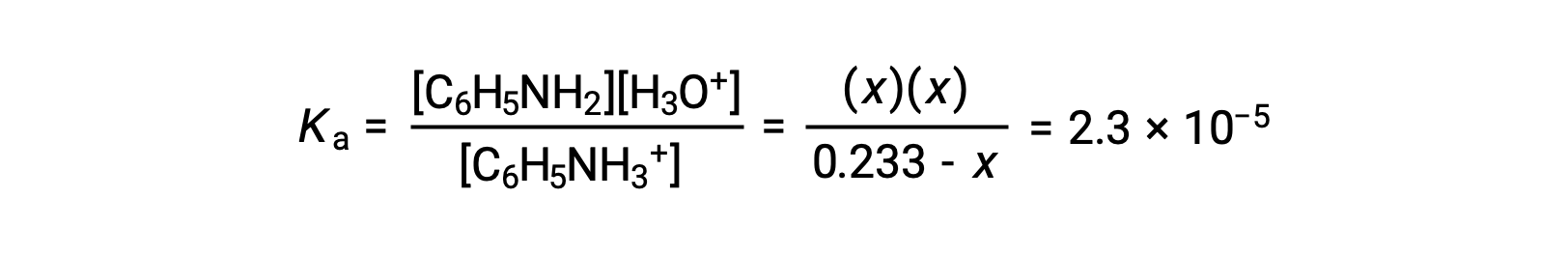
Supponendo x << 0,233, l'equazione è semplificata e risolta per x:
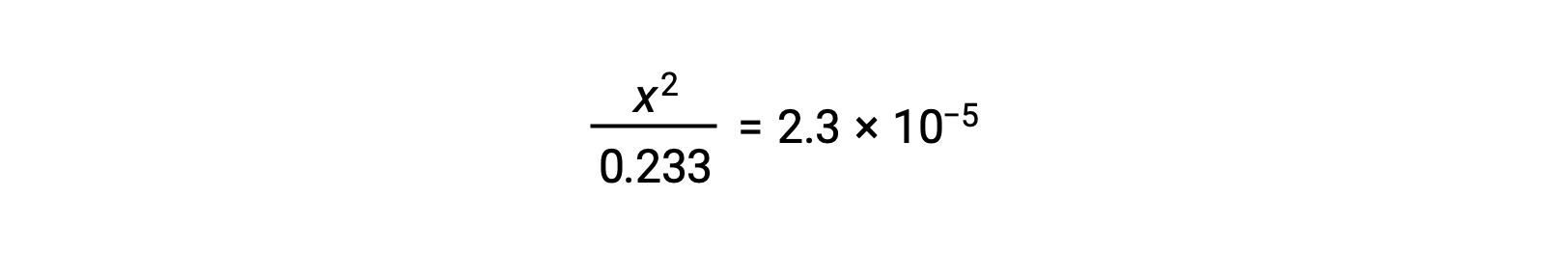

La tabella ICE definisce x come la molarità ionico dell’idronio, e quindi il pH è calcolato come
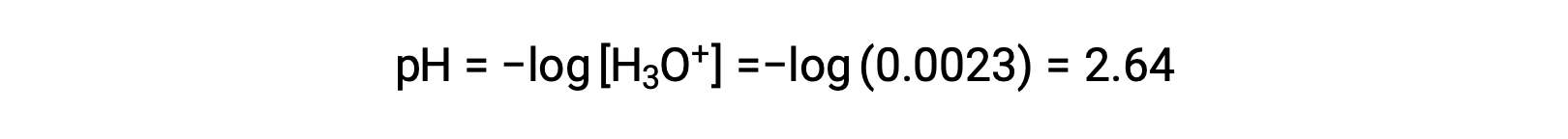
Idrolisi di [Al(H2O)6]3+
Calcola il pH di una soluzione da 0,10 M di cloruro di alluminio, che si dissolve completamente per dare allo ione di alluminio idratato [Al(H2O)6]3 + in soluzione.
L’equazione per la reazione e Ka sono:
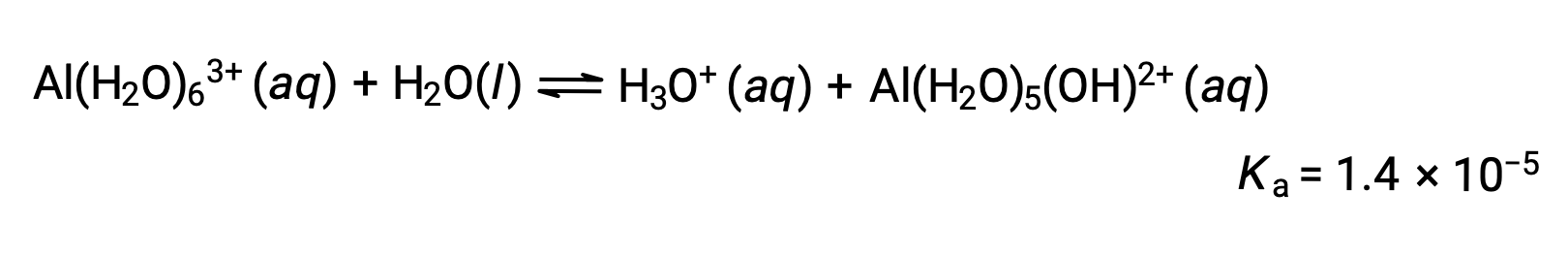
Una tabella ICE con le informazioni fornite è
| Al(H2O)63+ (aq) | H3O+ (aq) | Al(H2O)5(OH)2+ (aq) | |
| Concentrazione iniziale (M) | 0.10 | ~0 | 0 |
| Variazione (M) | −x | +x | +x |
| Concentrazione di equilibrio (M) | 0,10 − x | X | X |
Sostituendo le espressioni per le concentrazioni di equilibrio nell’equazione con le rese costanti di ionizzazione:

Supponendo x << 0,10 e risolvendo l'equazione semplificata si ottiene:
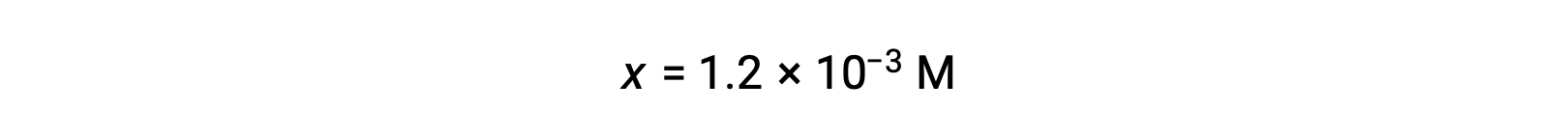
La tabella ICE ha definito x come uguale alla concentrazione di ioni idronio, e quindi il pH è calcolato come 2,92, e la soluzione è acida.
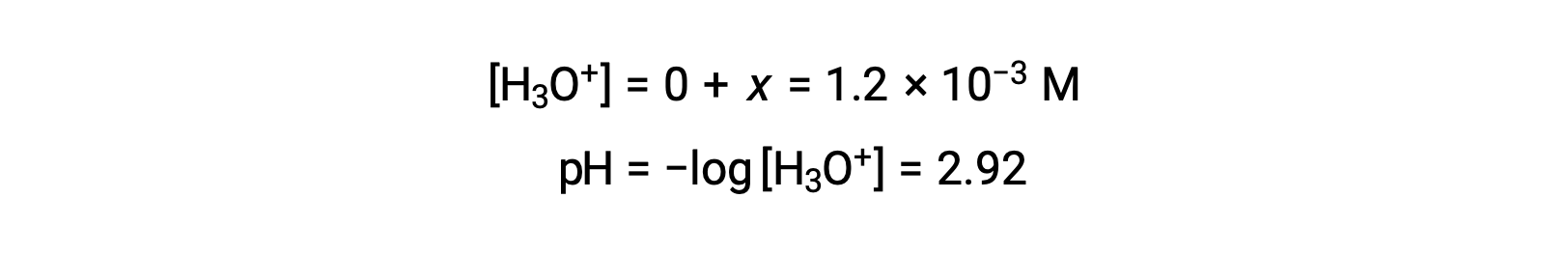
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.4: Idrolisi dei Sali.
