15.12:
Acidi poliprotici
15.12:
Acidi poliprotici
Gli acidi sono classificati in base al numero di protoni per molecola a cui possono rinunciare in una reazione. Acidi come HCl, HNO3e HCN che contengono un atomo di idrogeno ionizzabile in ogni molecola sono chiamati acidi monoprotici. Le loro reazioni con l’acqua sono:
| Acidi monoprotici: Reazioni con acqua |
| HCl (aq) + H2O (l) ⟶ H3O+ (aq) + Cl− (aq) |
| HNO3 (aq) + H2O (l) ⟶ H3O+ (aq) + NO3− (aq) |
| HCN (aq) + H2O (l) ⇌ H3O+ (aq) + CN− (aq) |
Anche se contiene quattro atomi di idrogeno, l’acido acetico, CH3CO2H, è anche monoprotico perché solo l’atomo di idrogeno del gruppo carbossile (COOH) reagisce con le basi:
Allo stesso modo, le basi monoprotiche sono basi che accetteranno un singolo protone.
Gli acidi diprotici contengono due atomi di idrogeno ionizzabili per molecola; la ionizzazione di tali acidi avviene in due fasi. La prima ionizzazione avviene sempre in misura maggiore rispetto alla seconda ionizzazione. Ad esempio, l’acido solforico, un acido forte, ionizza come segue:
| Acido diprotico: Acido solforico (H2SO4) | ||
| Ionizzazione 1 | H2SO4 (aq) + H2O (l) ⇌ H3O+ (aq) + HSO4− (aq) | Ka1 = più di 102; dissociazione completa |
| 2a ionizzazione | HSO4− (aq) + H2O (l) ⇌ H3O+ (aq) + SO42− (aq) | Ka2 = 1,2 × 10−2 |
Questo processo di ionizzazione graduale si verifica per tutti gli acidi poliprotici. L’acido carbonico, H2CO3, è un esempio di acido diprotico debole. La prima ionizzazione dell’acido carbonico produce ioni di idronio e ioni bicarbonato in piccole quantità.
Prima ionizzazione: H2CO3 (aq) + H2O (l) ⇌ H3O+ (aq) + HCO3− (aq)
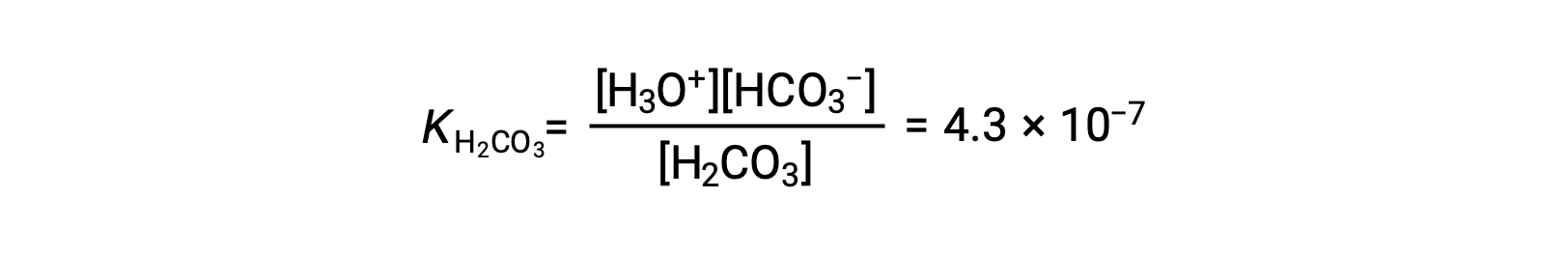
Lo ione bicarbonato può anche agire come acido. Ionizza e forma ioni idronio e ioni carbonato in quantità ancora minori.
Seconda ionizzazione: HCO3− (aq) + H2O (l) ⇌ H3O+ (aq) + CO32− (aq)
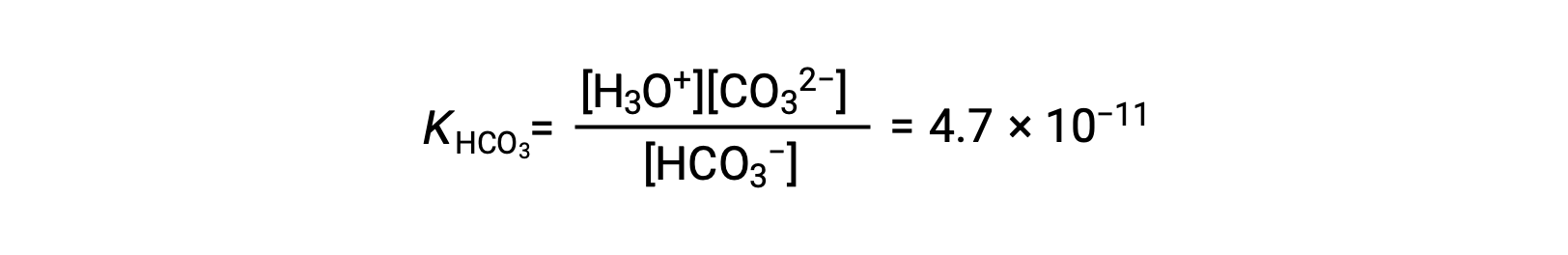
KH2CO3 è più grande di KHCO3− di un fattore di 104, quindi H2CO3 è il produttore dominante di ioni di idronio nella soluzione. Ciò significa che poco degli ioni HCO3− formati dalla ionizzazione di H2CO3 ionizza per dare ioni idronio (e ioni carbonato), e le concentrazioni di H3O+ e HCO3− sono praticamente uguali in una soluzione acquosa pura di H2CO3.
Se la prima costante di ionizzazione di un acido diprotico debole è maggiore della seconda di un fattore di almeno 20, è opportuno trattare separatamente la prima ionizzazione e calcolare le concentrazioni risultanti da essa prima di calcolare le concentrazioni di specie risultanti dalla successiva ionizzazione. Questo approccio è dimostrato nell’esercizio di esempio seguente.
Ionizzazione di un acido diprotico
“Acqua gassata” contiene una quantità appetibile di anidride carbonica disciolta. La soluzione è acida perché la CO2 reagisce con l’acqua per formare acido carbonico, H2CO3. Cosa sono [H3O+], [HCO3−], e [CO 32−] in unasoluzionesatura di CO2 con un iniziale [H2CO3] = 0,033?
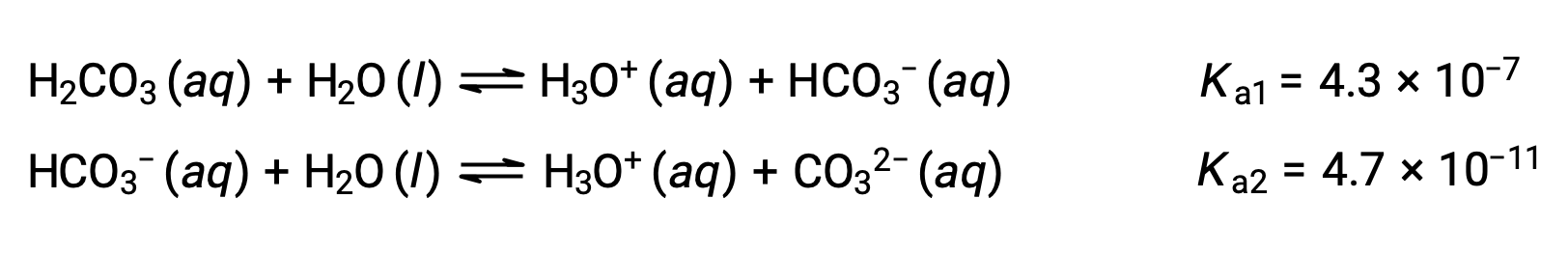
Come indicato dalle costanti di ionizzazione, H2CO3 è un acido molto più forte di HCO3−, quindi le reazioni di ionizzazione graduale possono essere trattate separatamente. Utilizzando le informazioni fornite, viene preparata una tabella ICE per questa prima fase di ionizzazione:
| H2CO3 (aq) | H3O+ (aq) | HCO3− (aq) | |
| Concentrazione iniziale (M) | 0.033 | ~0 | 0 |
| Variazione (M) | −x | +x | +x |
| Concentrazione di equilibrio (M) | 0,033 − x | X | X |
Sostituendo le concentrazioni di equilibrio nell’equazione di equilibrio si ottiene
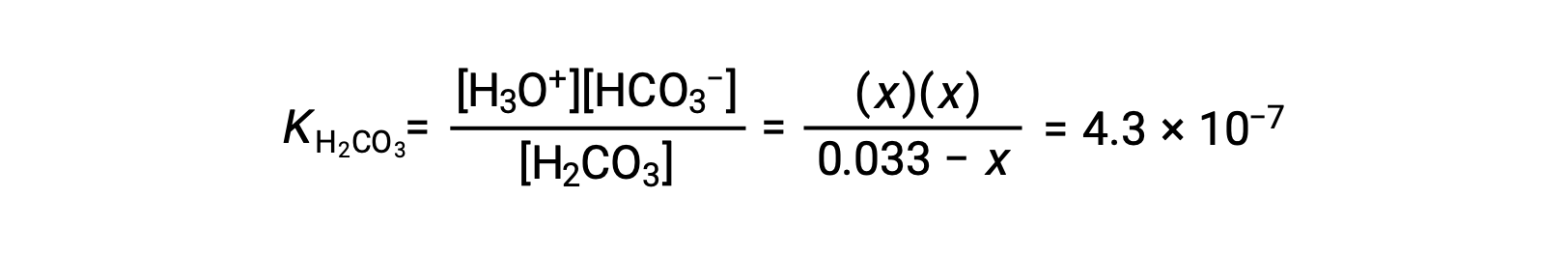
Supponendo x << 0,033 e risolvendo l'equazione semplificata si ottiene
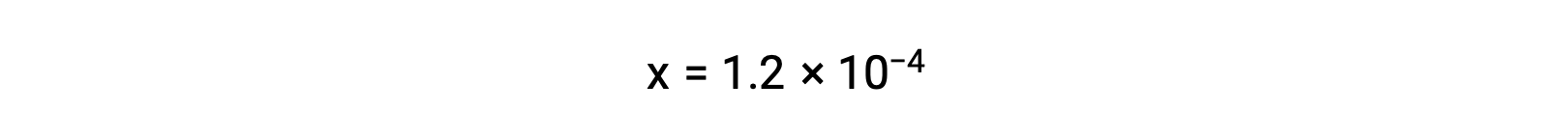
La tabella ICE ha definito x come uguale alla molarità ionico bicarbonato e alla molarità ionico idronio:
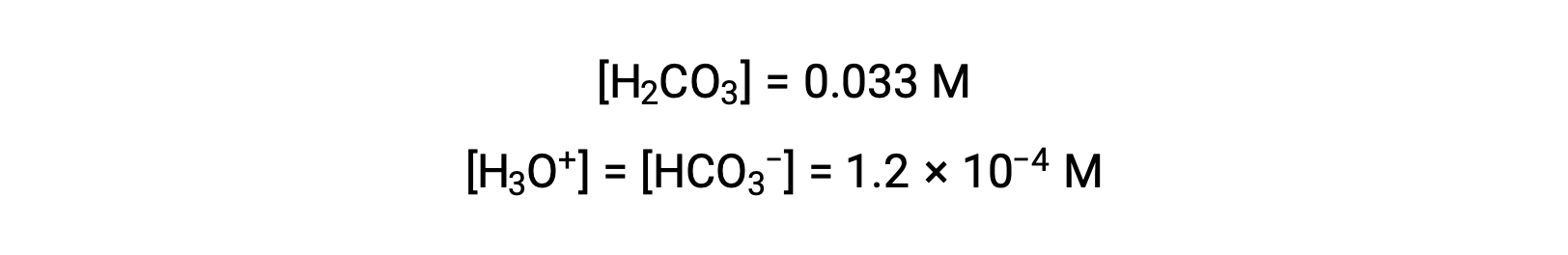
Usando la concentrazione di ioni bicarbonato calcolata sopra, la seconda ionizzazione è sottoposta a un calcolo di equilibrio simile: HCO3− (aq) + H2O (l) ⇌ H3O+ (aq) + CO32− (aq)
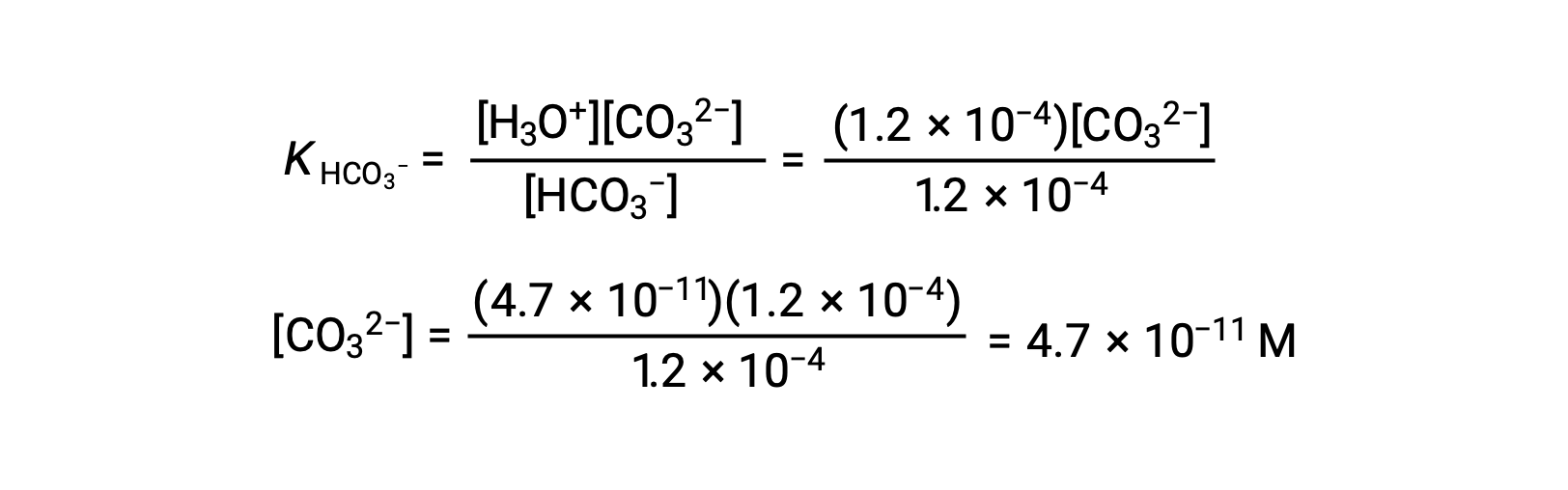
Per riassumere: all’equilibrio [H2CO3] = 0,033 M; [H3O+] = 1,2 × 10−4; [HCO3−] = 1,2 × 10−4 M; e [CO32−] = 4,7 × 10−11 M.
Un acido triprotico è un acido che ha tre atomi H ionizzabili. L’acido fosforico ne è un esempio:
| Acido triprotico: Acido fosforico (H3PO4) | ||
| Ionizzazione 1 | H3PO4 (aq) + H2O (l) ⇌ H3O+ (aq) + H2PO4− (aq) | Ka1 = 7,5 × 10−3 |
| 2a ionizzazione | H2PO4− (aq) + H2O (l) ⇌ H3O+ (aq) + HPO42− (aq) | Ka2 = 6,2 × 10-8 |
| 3° ionizzazione | HPO42− (aq) + H2O (l) ⇌ H3O+ (aq) + PO43− (aq) | Ka3 = 4,2 × 10−13 |
Per quanto riguarda gli esempi di acido diprotico, ogni reazione di ionizzazione successiva è meno estesa della prima, riflessa in valori decrescenti per le costanti di ionizzazione acida graduale. Questa è una caratteristica generale degli acidi poliprotici e le successive costanti di ionizzazione spesso differiscono di un fattore di circa 105-10 6.
Questo insieme di tre reazioni di dissociazione può sembrare complicare i calcoli delle concentrazioni di equilibrio in una soluzione di H3PO4. Tuttavia, poiché le costanti di ionizzazione successive differiscono di un fattore da 105 a 106, esistono grandi differenze nei piccoli cambiamenti di concentrazione che accompagnano le reazioni di ionizzazione. Ciò consente l’uso di ipotesi e processi che semplificano la matematica, come dimostrato negli esempi precedenti. Le basi poliprotiche sono in grado di accettare più di uno ione idrogeno. Lo ione carbonato è un esempio di base diprotica, perché può accettare due protoni, come mostrato di seguito. Simile al caso degli acidi poliprotici, si noti che le costanti di ionizzazione diminuiscono con la fase di ionizzazione. Allo stesso modo, i calcoli di equilibrio che coinvolgono basi poliprotiche seguono gli stessi approcci di quelli per gli acidi poliprotici.

Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.5: Acidi Poliprotici.
