16.9:
Titolazione di un acido poliprotico
16.9:
Titolazione di un acido poliprotico
Un acido poliprotico contiene più di un idrogeno ionizzabile e subisce un processo di ionizzazione graduale. Se le costanti di dissociazione acida dei protoni ionizzabili differiscono sufficientemente l’una dall’altra, allora la curva di titolazione per tale acido poliprotico genera un punto di equivalenza distinto per ciascuno dei suoi idrogeno ionizzabili. Pertanto, la titolazione di un acido diprotico si traduce nella formazione di due punti di equivalenza, mentre la titolazione di un acido triprotico si traduce nella formazione di tre punti di equivalenza sulla curva di titolazione.
L’acido carbonico, H2CO3, è un esempio di acido diprotico debole. La prima ionizzazione dell’acido carbonico produce ioni di idronio e ioni bicarbonato in piccole quantità.
Prima ionizzazione:
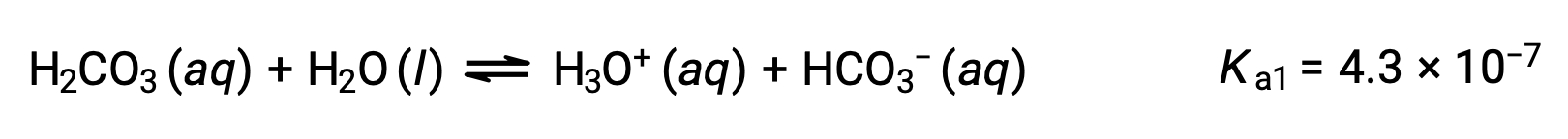
Lo ione bicarbonato può anche agire come acido. Ionizza e forma ioni idronio e ioni carbonato in quantità ancora minori.
Seconda ionizzazione:
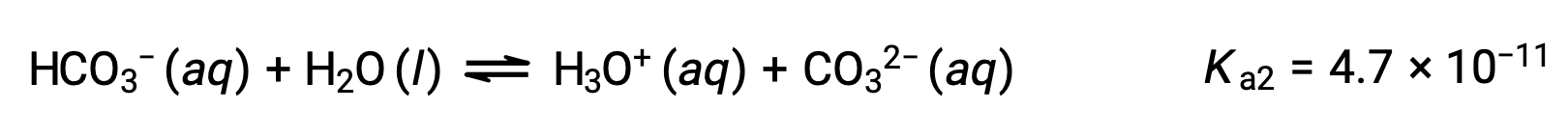
Il Ka1 è più grande del Ka2 di un fattore 104. Pertanto, quando H2CO3 è titolazione con una base forte come NaOH, produce due punti di equivalenza distinti per ogni idrogeno ionizzabile.
Acido fosforico, un acido triprotico, ionizza in tre fasi:
Prima ionizzazione:
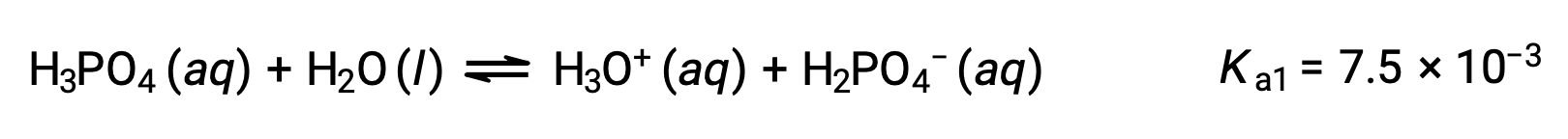
Seconda ionizzazione:
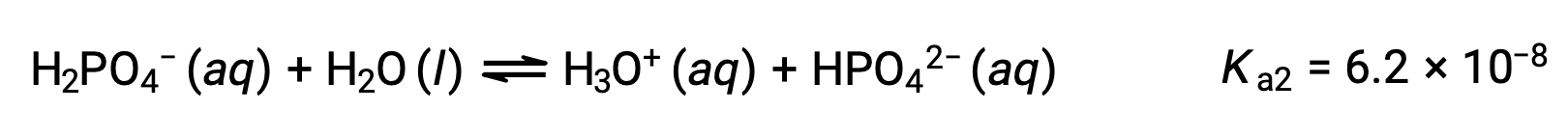
Terza ionizzazione:
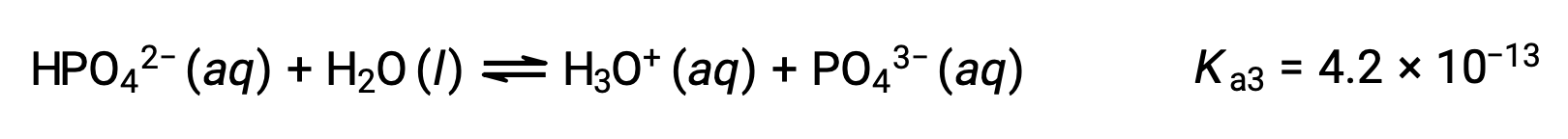
Quando H3PO4 è titolato con una base forte come KOH, produce tre punti di equivalenza per ogni idrogeno ionizzabile. Tuttavia, poiché HPO42− è un acido molto debole, il terzo punto di equivalenza non è facilmente percepibile sulla curva di titolazione.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.5: Acidi Poliprotici.
