17.4:
Terza legge della termodinamica
17.4:
Terza legge della termodinamica
Un solido puro, perfettamente cristallino che non possiede energia cinetica (cioè ad una temperatura di zero assoluto, 0 K) può essere descritto da un singolo microstato, poiché la sua purezza, la perfetta cristallinità e la completa mancanza di movimento significa che c’è solo una posizione possibile per ogni atomo o molecola identica che comprende il cristallo(W = 1). Secondo l’equazione di Boltzmann, l’entropia di questo sistema è zero.
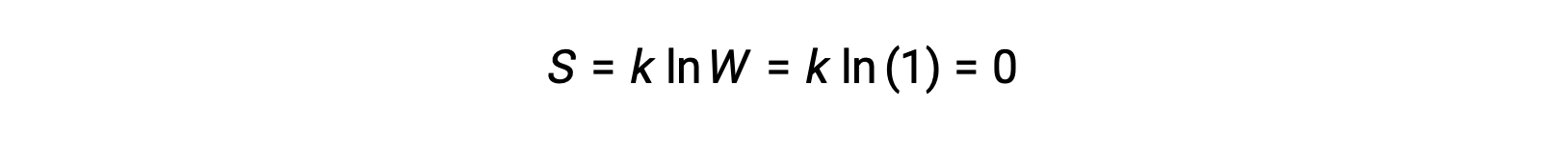
Questa condizione limitante per l’entropia di un sistema rappresenta la terza legge della termodinamica: l’entropia di una sostanza cristallina pura e perfetta a 0 K è zero.
Possono essere effettuate misurazioni calorimetriche accurate per determinare la dipendenza dalla temperatura dell’entropia di una sostanza e per ricavare valori di entropia assoluta in condizioni specifiche. Le entropie standard (S°) sono per una talpa di una sostanza in condizioni standard. Diverse sostanze hanno diversi valori standard di entropia molare a seconda dello stato fisico della sostanza, della massa molare, delle forme allotropiche, della complessità molecolare e dell’estensione della dissoluzione.
A causa della maggiore dispersione di energia tra le particelle sparse nella fase gassosa, le forme gassose di sostanze tendono ad avere entalpie molare standard molto più grandi delle loro forme liquide. Per ragioni simili, le forme liquide di sostanze tendono ad avere valori maggiori rispetto alle loro forme solide. Ad esempio, S°H2O (l) = 70 J/mol· K e S°H2O (g) = 188,8 J/mol·K.
Tra gli elementi nello stesso stato, l’elemento più pesante (massa molare più grande) ha un valore di entropia molare standard più elevato rispetto all’elemento più leggero. Ad esempio, S°Ar (g) = 154,8 J/mol· K e S°Xe (g) = 159,4 J/mol·K.
Allo stesso modo, tra le sostanze allo stesso stato, le molecole più complesse hanno valori di entalpia molare standard più elevati rispetto a quelli più semplici. Ci sono più possibili arrangiamenti di atomi in molecole più grandi e complesse, il che aumenta il numero di possibili microstati. Ad esempio, S°Ar (g) = 154,8 J/mol· K e S°NO (g) = 210,8 J/mol· K nonostante la maggiore massa molare dell’argon. Questo perché nell’argon gassoso, l’energia assume la forma di moto traslazionale degli atomi, mentre nell’ossido nitrico gassoso (NO), l’energia assume la forma di movimento traslazionale, movimento rotazionale e (a temperature abbastanza elevate) movimenti vibrazionali delle molecole.
L’entropia molare standard di qualsiasi sostanza aumenta con l’aumentare della temperatura. Nelle transizioni di fase, come dal solido al liquido e dal liquido al gas, si verificano grandi salti nell’entropia, che è dovuto all’improvviso aumento della mobilità molecolare e ai maggiori volumi disponibili associati ai cambiamenti di fase.
Questo testo è adattato da Openstax, Chimica 2e, Capitolo 16.2: La seconda e terza legge della termodinamica.
