17.7:
Effetti della temperatura sull'energia libera
17.7:
Effetti della temperatura sull'energia libera
La spontaneità di un processo dipende dalla temperatura del sistema. Le transizioni di fase, ad esempio, procederanno spontaneamente in una direzione o nell’altra a seconda della temperatura della sostanza in questione. Allo stesso modo, alcune reazioni chimiche possono anche mostrare spontaneità dipendenti dalla temperatura. Per illustrare questo concetto, l’equazione relativa al cambiamento di energia libera all’entalpia e ai cambiamenti di entropia per il processo è considerata:
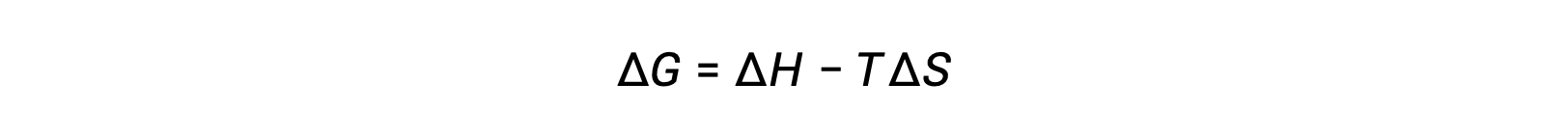
La spontaneità di un processo, come si riflette nel segno aritmetico del suo cambiamento di energia libera, è quindi determinata dai segni dei cambiamenti di entalpia ed entropia e, in alcuni casi, dalla temperatura assoluta. Poiché T è la temperatura assoluta (kelvin), può avere solo valori positivi. Esistono quindi quattro possibilità per quanto riguarda i segni dell’entalpia e dei cambiamenti di entropia:
- Sia ΔH che ΔS sono positivi. Questa condizione descrive un processo endotermico che comporta un aumento dell’entropia del sistema. In questo caso, ΔG sarà negativo se la magnitudine del termine TΔS è maggiore di ΔH. Se il termine TΔS è minore di ΔH, il cambiamento di energia libera sarà positivo. Tale processo è spontaneo ad alte temperature e nonpontaneo a basse temperature.
- Sia ΔH che ΔS sono negativi. Questa condizione descrive un processo esotermico che comporta una diminuzione dell’entropia del sistema. In questo caso, ΔG sarà negativo se la magnitudine del termine TΔS è minore di ΔH. Se la magnitudinedeltermine T Δ S è maggiore di ΔH, il cambiamento di energia libera sarà positivo. Tale processo è spontaneo a basse temperature e nonpontaneo ad alte temperature.
- ΔH è positivo, e ΔS è negativo. Questa condizione descrive un processo endotermico che comporta una diminuzione dell’entropia del sistema. In questo caso, ΔG sarà positivo indipendentemente dalla temperatura. Tale processo non èpontaneo a tutte le temperature.
- ΔH è negativo e ΔS è positivo. Questa condizione descrive un processo esotermico che comporta un aumento dell’entropia del sistema. In questo caso, ΔG sarà negativo indipendentemente dalla temperatura. Un tale processo è spontaneo a tutte le temperature.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 16.4: Energia Libera.
