17.8:
Calcolo della variazione di energia libera standard
17.8:
Calcolo della variazione di energia libera standard
Il cambiamento di energia libera per una reazione che si verifica nelle condizioni standard di pressione di 1 barra e a 298 K è chiamato cambio di energia libero standard. Poiché l’energia libera è una funzione di stato, il suo valore dipende solo dalle condizioni degli stati iniziale e finale del sistema. Un approccio conveniente e comune al calcolo dei cambiamenti di energia libera per le reazioni fisiche e chimiche è l’uso di raccolte ampiamente disponibili di dati termodinamici allo stato standard. Un metodo prevede l’uso di entalpie e entropie standard per calcolare i cambiamenti di energia libera standard, ΔG°, secondo la seguente relazione.
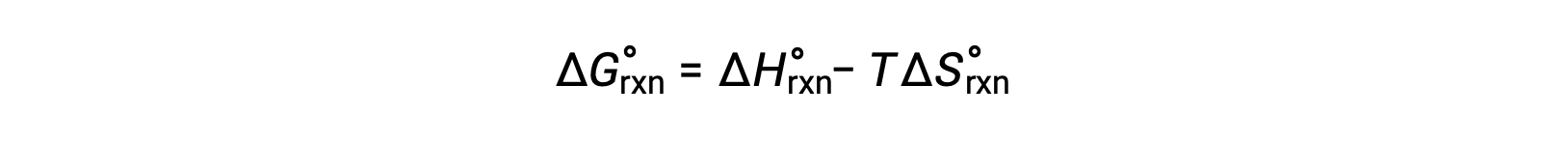
Il cambiamento di energia libera standard per una reazione può anche essere calcolato dall’energia libera standard di formazione ΔGf° valori dei reagenti e dei prodotti coinvolti nella reazione. L’energia libera standard di formazione è il cambiamento di energia libera che accompagna la formazione di una talpa di una sostanza dai suoi elementi nei loro stati standard. Simile all’entalpia standard di formazione, ΔGf° è per definizione zero per le sostanze elementali in condizioni di stato standard. Per la reazione
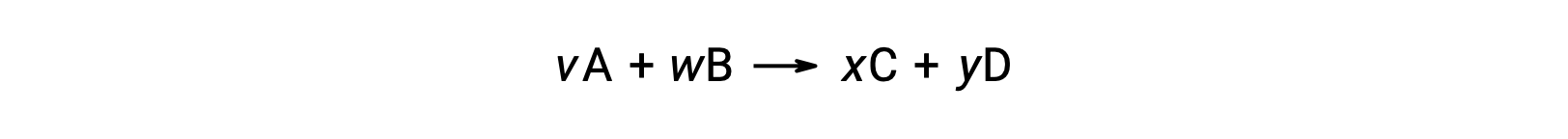
il cambiamento di energia libero standard a temperatura ambiente può essere calcolato come
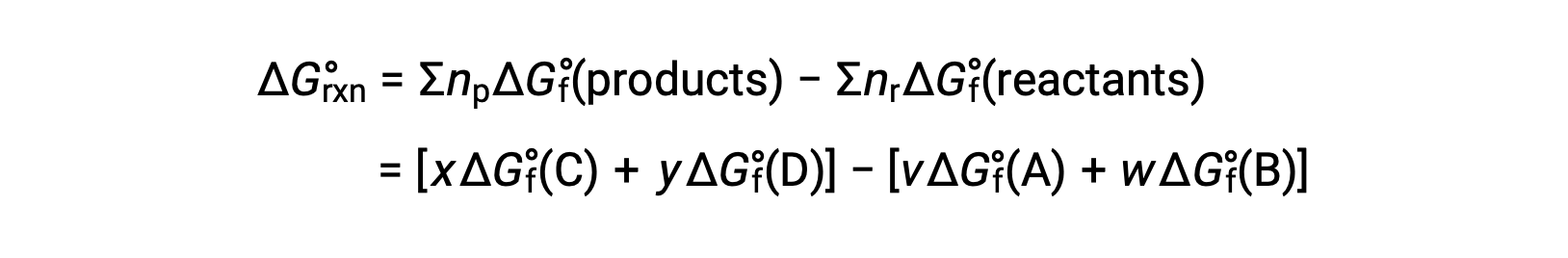
L’uso di energie libere di formazione per calcolare i cambiamenti di energia libera per le reazioni come descritto sopra è possibile perché ΔG è una funzione di stato, e l’approccio è analogo all’uso della Legge di Hess nel calcolo dei cambiamenti di entalpia. Considera la vaporizzazione dell’acqua come esempio:
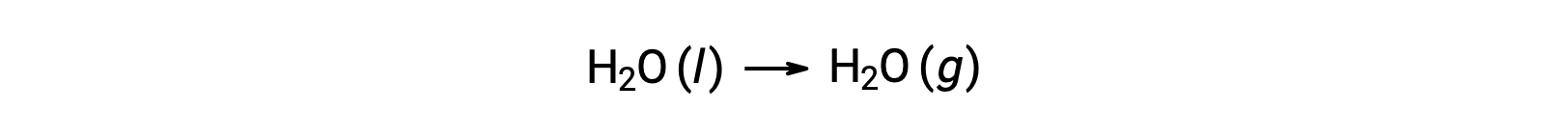
Un’equazione che rappresenta questo processo può essere derivata aggiungendo le reazioni di formazione per le due fasi dell’acqua (necessariamente invertendo la reazione per la fase liquida). Il cambiamento di energia libera per la reazione di somma è la somma dei cambiamenti di energia libera per le due reazioni aggiunte:
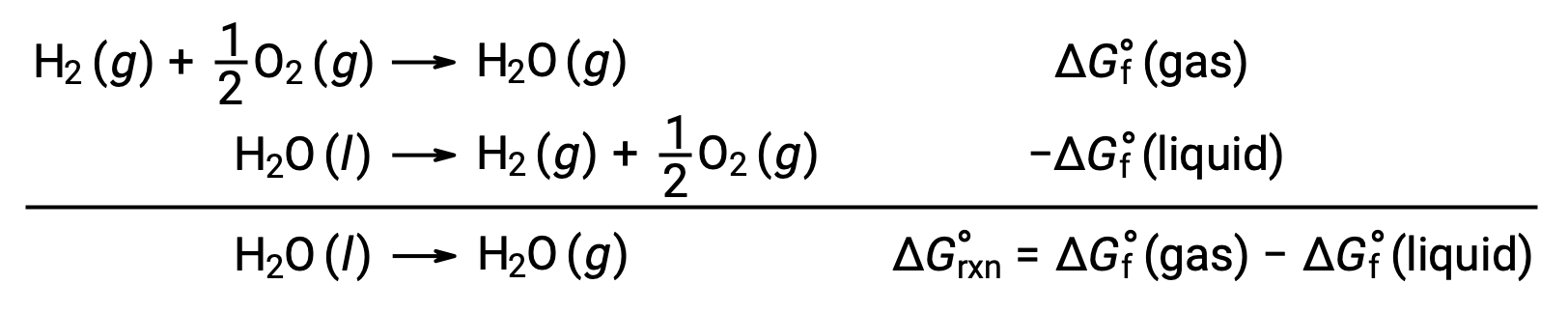
Questo approccio può essere utilizzato anche nei casi in cui una reazione non spontanea è abilitata accoppiandola ad una reazione spontanea. Ad esempio, la produzione di zinco elementale dal solfuro di zinco è termodinamicamente sfavorevole, come indicato da un valore positivo per ΔG°1:
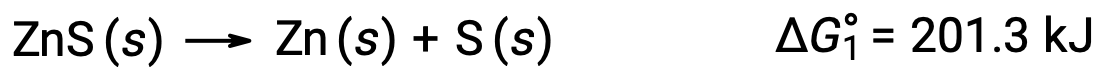
Il processo industriale per la produzione di zinco da minerali sulfidici comporta l’accoppiamento di questa reazione di decomposizione all’ossidazione termodinamicamente favorevole dello zolfo:

La reazione accoppiata mostra un cambiamento di energia libero negativo ed è spontanea:
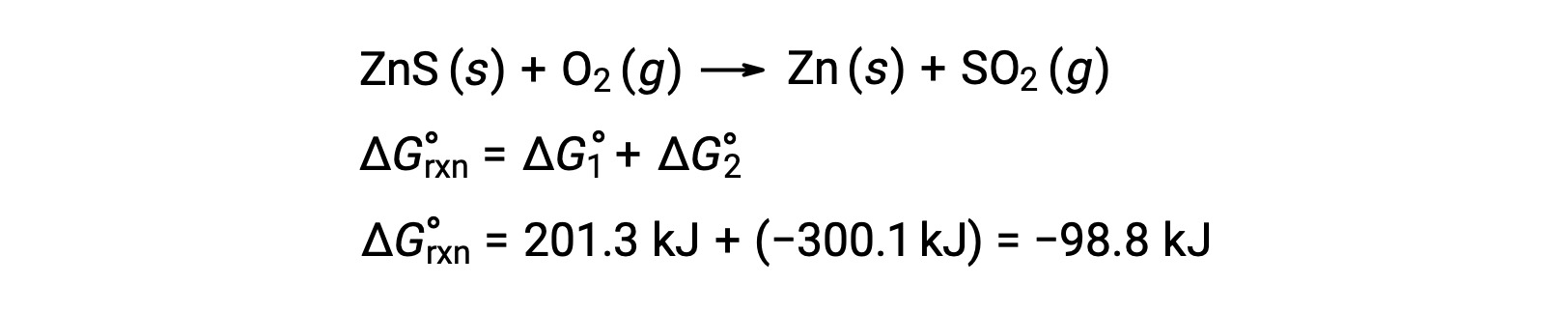
Questo processo viene in genere eseguito a temperature elevate, quindi questo risultato ottenuto utilizzando valori energetici liberi standard è solo una stima. Il valore del calcolo, tuttavia, è vero.
Questo testo è adattato da Openstax, Chimica 2e, Capitolo 16.4: Energia Libera.
