20.10:
Colori e magnetismo
20.10:
Colori e magnetismo
Colori nei complessi di coordinazione
Quando atomi o molecole assorbono la luce alla frequenza corretta, i loro elettroni sono eccitati per orbitali ad alta energia. Per molti atomi e molecole di gruppo principali, i fotoni assorbiti si trovano nell’intervallo ultravioletto dello spettro elettromagnetico, che non può essere rilevato dall’occhio umano. Per i composti di coordinazione, la differenza di energia tra gli orbitali d spesso permette ai fotoni nell’intervallo visibile di essere assorbiti ed emessi, che è visto come colori dall’occhio umano.
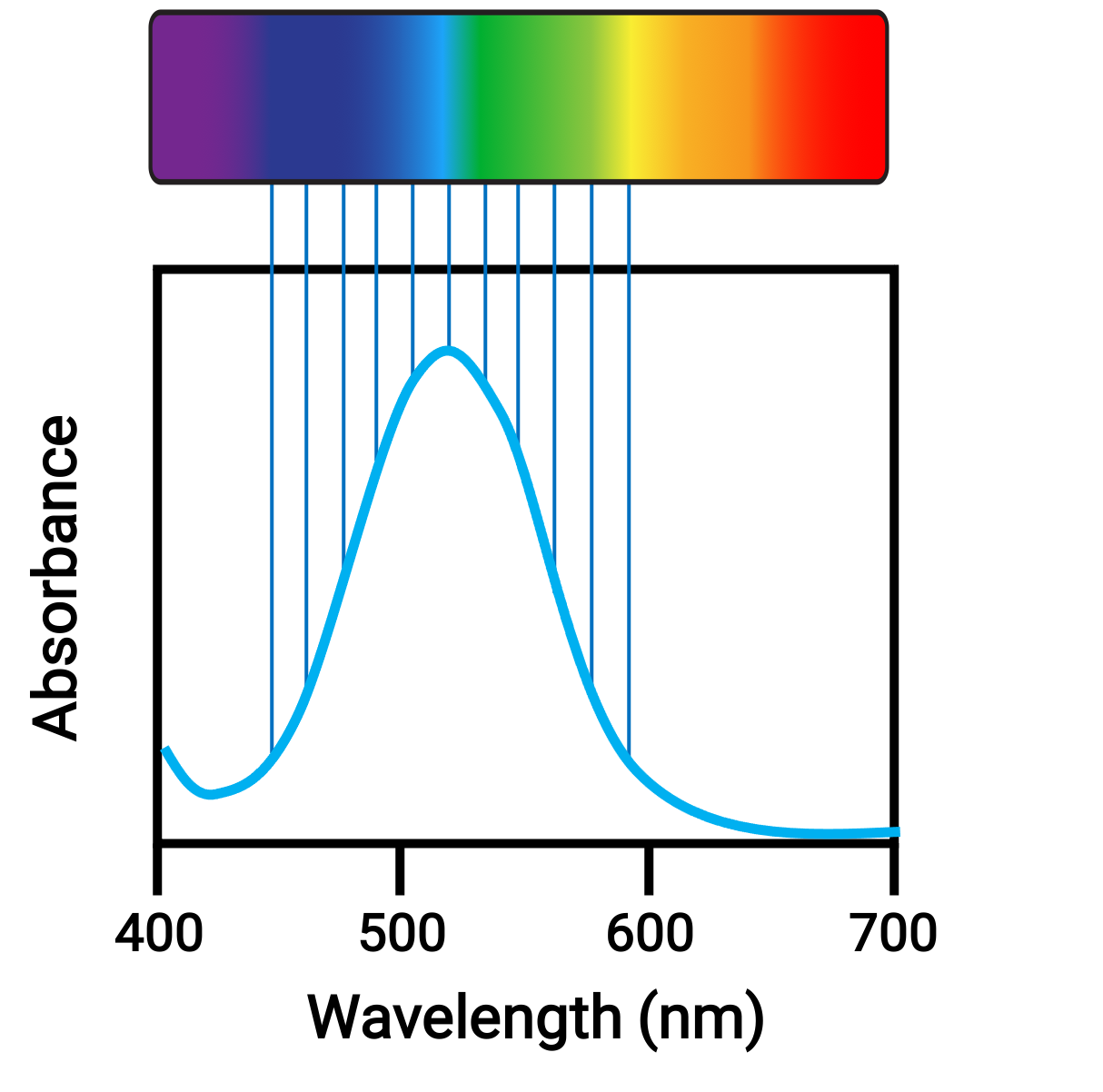
Figura 1. Spettro elettromagnetico di luce visibile e assorbanza.
Piccoli cambiamenti nelle energie relative degli orbitali tra cui gli elettroni stanno passando possono portare a drastici cambiamenti nel colore della luce assorbita. Pertanto, i colori dei composti di coordinazione dipendono da molti fattori, come:
• Diversi ioni metallici acquosi possono avere colori diversi.
• Diversi stati di ossidazione di un metallo possono produrre colori diversi.
• Ligandi specifici coordinati al centro metallico influenzano il colore dei complessi di coordinazione. Ad esempio, il complesso ferro(II) [Fe(H2O)6]SO4 appare blu-verde perché il complesso ad alto spin assorbe i fotoni nelle lunghezze d’onda rosse. Al contrario, il complesso di ferro a basso spin(II) K4[Fe(CN)6] appare giallo pallido perché assorbe fotoni viola ad alta energia.
In generale, i ligandi a campo forte causano una grande divisione nelle energie degli orbitali d dell’atomo metallico centrale (grande Δ). I composti di coordinazione dei metalli di transizione con questi ligandi sono gialli, arancioni o rossi perché assorbono la luce viola o blu ad alta energia.
D’altra parte, i composti di coordinazione dei metalli di transizione con ligandi a campo debole sono spesso blu-verde, blu o indaco perché assorbono la luce gialla, arancione o rossa a bassa energia. La forza dei ligandi di dividere gli orbitali d è elencata nella serie spettrochimica. Qui i ligandi sono scritti nel valore crescente dell’energia di scissione del campo cristallino (Δ).

Figura 2. Serie spettrochimica.
Per esempio, un composto di coordinazione dello ione Cu+ ha una configurazione d10, e tutti gliorbitalieg sono riempiti. Per eccitare un elettrone ad un livello superiore, come l’orbitale 4p, sono necessari fotoni ad altissima energia. Questa energia corrisponde a lunghezze d’onda molto corte nella regione ultravioletta dello spettro. Nessuna luce visibile viene assorbita, quindi l’occhio non vede alcun cambiamento e il composto appare bianco o incolore. Una soluzione contenente [Cu(CN)2]−, ad esempio, è incolore. D’altra parte, i complessi ottaedri cu2+ hanno un posto vacante negli orbitali e g, e gli elettroni possono essere eccitati a questo livello. La lunghezza d’onda (energia) della luce assorbita corrisponde alla parte visibile dello spettro, e i complessi di Cu2+ sono quasi sempre colorati: blu, blu-verde viola o giallo.
Magnetismo nei complessi di coordinamento
L’evidenza sperimentale delle misurazioni magnetiche supporta la teoria dei complessi ad alto e basso spin. Molecole come O2 che contengono elettroni spaiati sono paramagnetiche. Le sostanze paramagnetiche sono attratte dai campi magnetici. Molti complessi metallici di transizione hanno elettroni spaiati e quindi sono paramagnetici. Molecole come N2 e ioni come Na+ e [Fe(CN)6]4− che non contengono elettroni spaiati sono diamagnetiche. Le sostanze diamagnetiche hanno una leggera tendenza ad essere respinte dai campi magnetici.
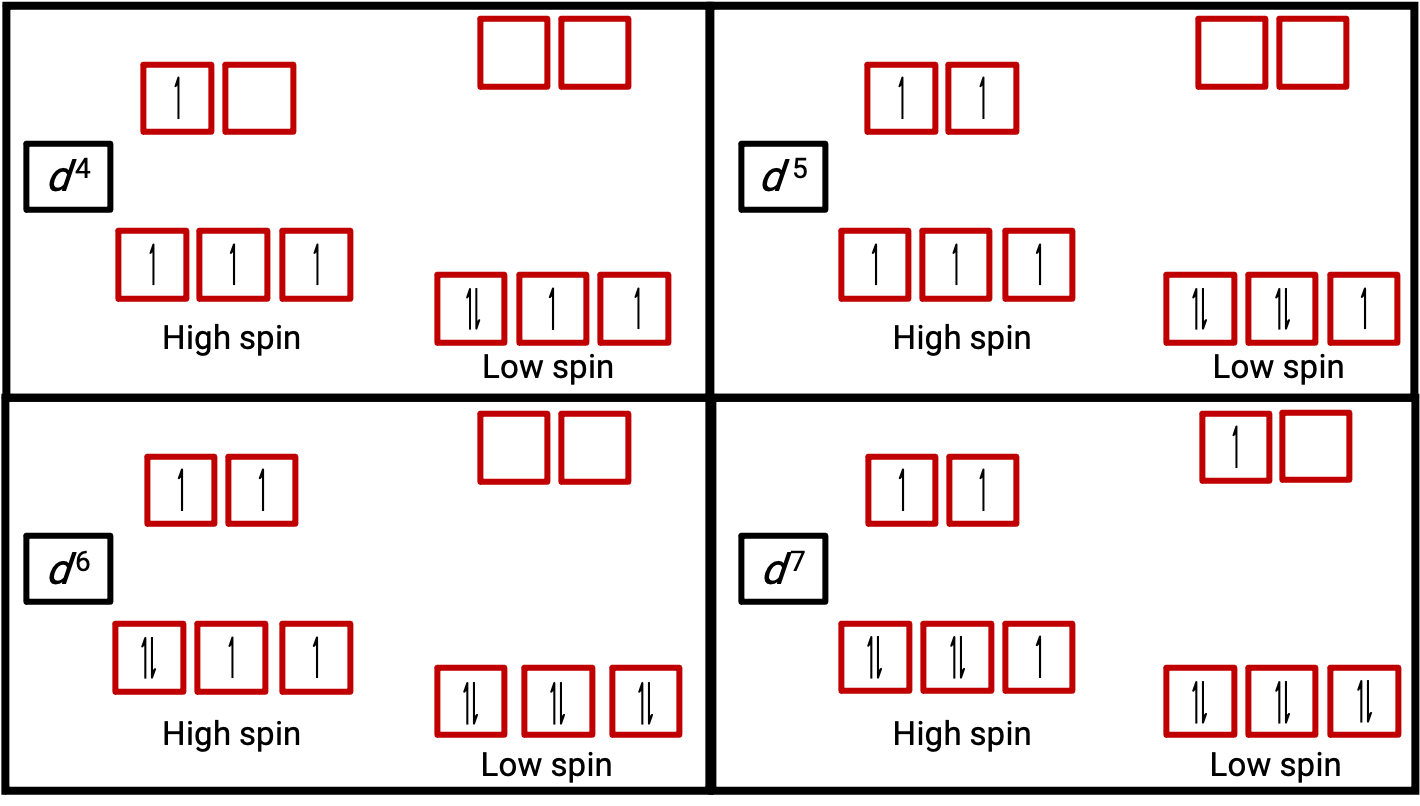
Figura 3. Diagrammi orbitali dei complessi ottaedri nello stato di spin alto e basso per i sistemi d4, d5, d6e d7. Questa distinzione non può essere fatta per i sistemi d1, d2, d3, d5, d8,d9 e d10.
Quando un elettrone in un atomo o in uno ione è spaiato, il momento magnetico dovuto al suo spin rende l’intero atomo o ione paramagnetico. La dimensione del momento magnetico di un sistema contenente elettroni spaiati è correlata direttamente al numero di tali elettroni: maggiore è il numero di elettroni spaiati, maggiore è il momento magnetico. Pertanto, il momento magnetico osservato è usato per determinare il numero di elettroni spaiati presenti. Il momento magnetico misurato di basso spin d6 [Fe(CN)6]4− conferma che il ferro è diamagnetico, mentre l’altospin d6 [Fe(H2O)6]2+ ha quattro elettroni spaiati con un momento magnetico che conferma questa disposizione (Figura 2).
Questo testo è adattato da Openstax, Chemistry 2e, Section19.3: Proprietà spettroscopiche e magnetiche dei composti di coordinazione.
