Tecniche di Imaging Ca 2 + Segnalazione di sperma umano
Summary
Stimolo-evocato [Ca<sup> 2 +</sup>] I segnali dei singoli spermatozoi umani sono valutati. Cellule mobili sono caricati con Ca<sup> 2 +</sup> Sensibili colorante fluorescente (AM-estere metodo) e immobilizzato in una camera perfusable. Le cellule sono ripreso dal time-lapse microscopia a fluorescenza e stimolato attraverso il medium di perfusione. Le risposte di singole cellule (o regioni) sono analizzati in linea con Excel.
Abstract
Microscopia a fluorescenza di cellule caricate con fluorescenti, Ca<sup> 2 +</sup> Sensibile coloranti viene utilizzato per la misurazione degli aspetti spaziali e temporali di Ca<sup> 2 +</sup> Segnalazione in cellule vive. Qui si descrive il metodo utilizzato nei nostri laboratori per caricare sospensioni di sperma umano con Ca<sup> 2 +</sup> Segnalazione coloranti e misurando il segnale di fluorescenza durante la stimolazione fisiologica. Cellule mobili sono isolati diretto swim-up e incubate in condizioni capacitating per 0-24 ore, a seconda dell'esperimento. La cellula-permeanti AM (acetossi estere metilico) forma estere del Ca<sup> 2 +</sup> Segnalazione colorante viene poi aggiunto ad una aliquota di cellule e un periodo di 1 h è consentito per il caricamento del colorante nel citoplasma. Noi usiamo coloranti lunghezza d'onda visibili per minimizzare foto-danni alle cellule, ma questo significa che la registrazione raziometrico non è possibile. Vantaggi e svantaggi di questo approccio sono discussi. Durante il periodo di celle di carico sono inseriti in una camera di imaging e il permesso di aderire ad una poli-D-lisina coprioggetto rivestito. Alla fine del colorante periodo di carico in eccesso e le cellule vengono rimosse da perdere il collegamento della camera per l'apparato di perfusione. La camera è perfuso continuamente, stimoli e saline modificati vengono poi aggiunti all'intestazione perfusione. Gli esperimenti vengono registrati dal time-lapse acquisizione di immagini a fluorescenza e analizzati in dettaglio in linea, disegnando manualmente le regioni di interesse. I dati sono normalizzati a pre-stimolo livelli tali che, per ogni cella (o parte di una cellula), un grafico che mostra il Ca<sup> 2 +</supRisposta> come il cambiamento% della fluorescenza si ottiene.
Protocol
Discussion
Se eseguite con successo, questa tecnica permette di registrare la distribuzione e la cinetica di spontaneo e indotto Ca 2 + segnali di sperma umano. Le risposte possono essere ottenute da un gran numero di cellule (fino a 200) che è importante in quanto lo sperma umano può mostrare un sacco di variazione nella loro spontanea e stimolata Ca 2 + segnali. L'etichettatura di successo e la sopravvivenza delle cellule durante la registrazione sono altamente dipendenti sulla qualità del campione. Campioni poveri danno etichettatura poveri, le risposte poveri e le cellule possono morire durante la registrazione.
Spermatozoi umani sono molto sensibili al foto-danni e quindi utilizzare l'illuminazione minima necessaria (sia l'intensità e tempo di esposizione) al fine di massimizzare la sopravvivenza cellulare e ridurre al minimo gli artefatti dovuti alla morte delle cellule. Una telecamera ad alta sensibilità (permettendo l'uso di illuminazione a bassa intensità) è un grande vantaggio in quanto la telecamera riprenderà fluorescenza debole. Retro-illuminato, EM-CCD sono particolarmente adatti, anche se molto costoso. Illuminazione a LED (invece di utilizzare una lampada allo xeno o mercurio con filtro di eccitazione migliora anche la sopravvivenza delle cellule (Nishigaki et al, 2006).
Non usiamo Fura-2, nonostante i vantaggi evidenti del rapporto-metrica delle immagini, perché Fura richiede l'eccitazione con luce UV e perché è necessario prendere due immagini per ogni rapporto. Per i dati ottenuti con singola lunghezza d'onda, coloranti luce visibile, la normalizzazione della fluorescenza compensa ampiamente la differenza di carico colorante tra le cellule, ma non per la distribuzione colorante all'interno di una singola cellula, e questo deve essere tenuto presente. Sebbene coloranti singola lunghezza d'onda può, in linea di principio, essere calibrato, l'accuratezza della tecnica è scarsa e non tentiamo di fare questo.
Considerando che i dati ottenuti con rapporto di Fura-2 (o l'emissione rapporto colorante indo), anche senza calibrazione, dare una rappresentazione accettabile fedele di variazioni relative a [Ca 2 +] i, l'intensità di fluorescenza dei coloranti singola lunghezza d'onda è tutt'altro che linearmente relative alla [Ca 2 +] i. Sopra la parte più utile della curva di saturazione del rapporto per le tinture singola lunghezza d'onda si avvicina di solito a logaritmica. Al momento stiamo utilizzando Oregon Verde Bapta-1 (Figura 4), perché è sensibile alle piccole variazioni [Ca 2 +] i di riposo vicino al livello s (50-100 nM). Quando [Ca 2 +] i supera 1 risposte microM saranno sottorappresentati in termini di cambiamento di fluorescenza e il colorante può saturare. Un'opzione per il miglioramento della tecnica senza ricorrere a eccitazione UV è di raddoppiare celle di carico con un colorante come Fluo-3 e Fura rosso. Entrambi possono essere eccitato a 488 nm, ma contemporaneamente le loro risposte sono molto diverse. Registrazione di emissione a 540 e 650 nm fornisce un rapporto che può fornire un metodo migliore per un accurato monitoraggio di [Ca 2 +] i (Haughland, 2002) e possono essere applicabili allo sperma (Nisigaki et al, 2006).
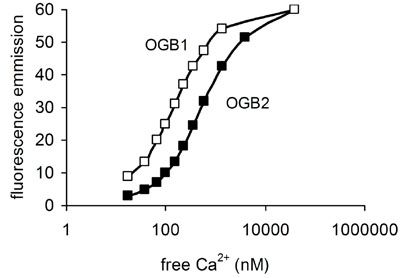
Figura 4. Relazione tra libera [Ca 2 +] (nm) ed emissione di fluorescenza a lunghezza d'onda massima (circa 525 nm) per Oregon Verde Bapta-1 e Oregon verde Bapta-2. OGB1 dà una maggiore fluorescenza a riposo [Ca 2 +] ma satura a livelli più bassi e quindi ha un range più piccolo utilizzabile. Dati per tali appezzamenti sono stati ottenuti dal Molecular Probes manuale (Haughland, 2002).
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è finanziato dal Wellcome Trust, il Medical Research Council, della Royal Society, Birmingham Science City e The Research Trust infertilità. Vorremmo riconoscere l'assistenza di esperti di ricerca Cairn nella costruzione e integrando gli impianti di perforazione di imaging.
Materials
| Material Name | Tipo | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Low light level Camera | QImaging | Rolera XR | ||
| Oregon Green BAPTA-1 | Invitrogen | 06807 | ||
| Imaging Software | Andor | IQ | ||
| Imaging Software | National Institues of Health | Image J | Public domain software | |
| LED illumination system | Cairn Research | Opto LED | ||
| Pluronic F-127 (20% solution in DMSO) | Invitrogen | P3000MP |
Riferimenti
- Haughland, R. P. . Handbook of Fluorescent Probes and Research Products. , (2002).
- Nishigaki, T., Wood, C. D., Shiba, K., Baba, S. A., Darszon, A. Stroboscopic illumination using light-emitting diodes reduces phototoxicity in fluorescence cell imaging. Biotechniques. 41, 191-197 (2006).

