אסטרטגיות לחקר neuroprotection מן הקרה נפשית מראש
Summary
אנו מבקשים להגדיר את האותות העצביים האחראים החיסונית קר נפשית מראש כאמצעי לזיהוי מטרות הרומן לפיתוח הרפוי כדי להגן על המוח לפני תחילת פציעה. אנו מציגים אסטרטגיות עבודה כזו הדורשים מערכות ביולוגיות, מניפולציות ניסיוני בתוספת היכולות הטכניות, כי הם לשעתקו מאוד רגיש.
Abstract
פציעה נוירולוגיות הוא הגורם השכיח של תחלואה ותמותה מן ההרדמה הכללית ניתוחים הקשורים שניתן להקל על ידי פיתוח יעיל, קל לניהול וטיפולים נפשית מראש בטוח. אנו מבקשים להגדיר את האותות העצביים האחראים החיסונית קר נפשית מראש כאמצעי לזיהוי מטרות הרומן לפיתוח הרפוי כדי להגן על המוח לפני תחילת פציעה. ברמה נמוכה הפרו דלקתי מתווך איתות שינויים לאורך זמן חיוניים neuroprotection קר נפשית מראש. איתות זה עולה בקנה אחד עם העקרונות הבסיסיים של hormesis מיזוג פיזיולוגיים, אשר דורשים גירויים irritative להגיע גודל סף עם מספיק זמן הסתגלות לגירויים להגנה להיות ברור.
לפיכך, התוויית איתות החיסון המעורבים neuroprotection קר נפשית מראש דורש כי מערכות ביולוגיות מניפולציות ניסיוני בתוספת היכולות הטכניות ולייצר מאוד רגיש. הגישה שלנו היא להשתמש תרבויות פרוסה בהיפוקמפוס כמו במודל חוץ גופית כי מקרוב משקף שלהם עם עמיתיהם vivo רב סינפטיים רשתות עצביות מושפע macroglia בוגרת שקט / microglia. מצב זה גליה חשוב במיוחד עבור microglia שכן הם המקור העיקרי של ציטוקינים, אשר פעיל בטווח femtomolar. כמו כן, תרבויות פרוסה יכול להישמר במבחנה במשך מספר שבועות, וזה מספיק זמן כדי לעורר גירויים הפעלת ולהעריך התגובות אדפטיבית. לבסוף, תנאים סביבתיים ניתן לשלוט בצורה מדויקת באמצעות תרביות פרוסה כך ציטוקינים כי האיתות של קר נפשית מראש ניתן למדוד, חיקה, ומתנגן לנתח את ההיבטים צומת קריטי. איתות ציטוקין מנתחת המערכת דורשת שימוש בטכניקות multiplexed רגיש לשחזור. אנו משתמשים כמותי PCR עבור TNF-α למסך להפעלת microglial ואחריו כמותי ההקרנה בזמן אמת qPCR מערך להעריך רקמות רחב שינויים ציטוקינים. האחרון הוא אמצעי רגיש ביותר לשחזור למדוד מערכת ציטוקינים מרובים איתות שינויים בו זמנית. שינויים משמעותיים הם אישרו עם qPCR ממוקד ולאחר מכן גילוי חלבון. אנחנו בדיקה עבור מבוססי רקמות ציטוקינים שינויים חלבון באמצעות זרם multiplexed microsphere מבחני cytometric באמצעות טכנולוגיית Luminex. תא ספציפי ייצור ציטוקינים נקבעת עם אימונוהיסטוכימיה פעמיים התווית. יחדיו, זו רקמת המוח הכנה וסגנון השימוש, מצמידים את האסטרטגיות החקירה הציע, יכול להיות גישה אופטימלית לזיהוי מטרות פוטנציאליות לפיתוח הרפוי הרומן הזה יכול לחקות את היתרונות של קר נפשית מראש.
Protocol
Discussion
שני מושגים חשובים ביסודו חשוב התיחום של מערכת איתות ציטוקינים המעורבים neuroprotection קר נפשית מראש מומחשים איורים 6 ו -7. ראשית, ציטוקינים הם ריכוז נמוך מאוד מולקולות איתות במוח הנורמלי. עם זאת, שינויים פיזיולוגיים ריכוז ציטוקינים יש פוטנציאל עצום לשנות את מבנה המוח ותפקודו (כלומר, פנוטיפ) בגלל היכולת שלהם לשנות את ביטוי הגנים (איור 6). יתר על כן, הציטוקינים הם מיותרים מאוד pleiotropic בכך ציטוקינים מרובים יכולה להיות השפעה דומה ציטוקין בודד יכולה להיות השפעה משתנה (איור 7). לכן, כדי לקבוע במדויק את המולדת ציטוקינים-בסיסים neuroprotection מהקור-נפשית מראש (או גירויים אחרים נפשית מראש פיזיולוגיים), ניתוח מורכב של משתנים הקשורים איתות חייבת להיות נחושה. מטרה זו מושגת באמצעות אסטרטגיות assay multiplexed. זה יהיה להקים את ציטוקינים "חתימה" של neuroprotection קר נפשית מראש.

איור 6. כוחה של ציטוקינים איתות במוח. האיורים להעביר את הכוח איתות עצום של ריכוזים פיזיולוגיים של ציטוקינים במוח לעומת ריכוזי מוכרת היטב עמיתיהם אחרים. ריכוז מיוצג ההופכי של המרחק, החל זיף חתול בודד כנקודת התייחסות. נתרן (מ -1 10 מאויר על ידי גרגר פלפל) ואשלגן (10 מ -3 מאויר על ידי עגבניה) נמצאים במרחב ביניים המוח ברמות של סביב 150 ו – 3 מ"מ, בהתאמה, יש מוכרים היטב תפקידים תאים עצביים לתפקד אלקטרו. כמו כן, ה-pH (כלומר, ~ 10 -7 M רמות של יוני מימן ואייר כמו 780 מטרים לאורך שפת האגם של שיקגו) וסידן (כלומר, ~ 10 -8 M רמות כפי שמוצג 7.8 ק"מ לראות תמונת לווין גוגל שפת האגם של שיקגו מ מקורמיק המקום לנקודה חרטום בהייד פארק ליד אוניברסיטת שיקגו). בנוסף, העצביים המשוחררים לחלל ביניים על ריכוזים אלה משפיעים על הפעילות המקומית אזור במוח. לעומת זאת, ציטוקינים (כפי שמוצג המרחק מכדור הארץ למאדים) יכול לשנות את תפקוד המוח בריכוזים יותר מעשר מיליון פעמים פחות.
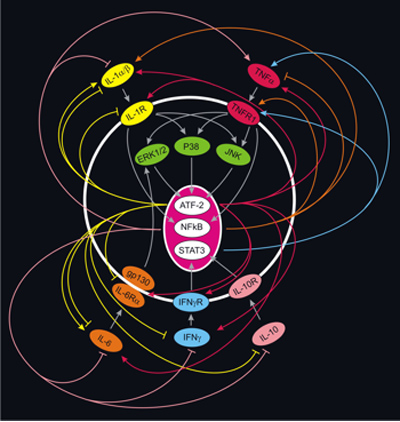
איור 7. איתות אינטראקטיבית של מסלולים ציטוקינים מולדים. ציטוקינים הם מיותרים מאוד pleiotropic בכך ציטוקינים מרובים יכולה להיות השפעה דומה ציטוקין בודד יכולה להיות השפעה משתנה. גיוון כזה נובעת איתות אינטראקטיביים מורכבים המתרחשת ברמה של ligands, קולטנים, ו phosphoproteins. מורכבות נוספת נובעת מהעובדה כי המוח מורכב של סוגי תאים שונים, שכל אחד מהם מסוגל ציטוקינים תא קולטן ספציפי מולדת, ושינויים phosphoprotein בנושא. לשם המחשה כאן, רק ציטוקינים מולדת איתות המסלולים (הנגזרות מחקרים תא החיסון) מוצגים. לשם הפשטות, המוח הוא נמשך כמו תא בודד (קו לבן) מראה את יחסי הגומלין פוטנציאל מולד ציטוקינים (IL-1α ו-IL-1β (המכונה כאן כמו IL-1α / β), TNF-α, IL-6, IFN-γ ו IL-10), קולטנים (IL-1R1, TNFR1, IL-6/gp130, IFNγR, ו-IL-10R), ו phosphoproteins (כלומר, קינאזות ERK1 / 2, p38 (p38-MAPK) ו JNK) ואת גורמי תעתוק (ATF-2, NFκB ו STAT3). לדוגמה, TNF-α אותות דרך TNFR1 כדי JNK, p38 ו-MAPK ERK1 / 2, אשר מפעילה ביטוי גנים באמצעות ATF-2. TNF-α גם משנה את ביטוי הגנים ישירות באמצעות הפעלת NFκB. יחד, הפעלה של גורמי שעתוק אלה מעוררות מוגברת (חץ) וירידה (סוף בוטה) ביטוי של ציטוקינים הקולטנים שלהם כפי שצוין. חשוב לציין, מסלולים אלה מראים כי שינויים ציטוקינים אחד (למשל, TNF-α) ההשפעה של ייצור (למשל, IL-1β) ציטוקינים אחרים. לכן, כדי להקים במדויק את ציטוקינים-בסיסים neuroprotection מהקור-נפשית מראש, ניתוח מורכב של משתנים הקשורים איתות חייבת להיות נחושה. זה יהיה להקים את ציטוקינים מולדת "חתימה" של קר נפשית מראש. (תמונה נערך מנתוני התייחסות # 25).
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
עבודה זו מומנה על ידי תרומות של המכון הלאומי להפרעות נוירולוגיות ושבץ (NS-19108), קרן מחקר מיגרנה, וקרן הלבן ריצ'רד פ 'Kraig. גב 'פ' מרשה Kraig סייעו בהכנת התקשורת בתרבות ותחזוקה של תרבויות פרוסה. אנו מודים ילנה גרינברג הערות ותיקונים אותה על גרסה סופית של מאמר זה.
Materials
Preparation of Slice Cultures
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| Millicell-CM tissue culture inserts (30 mm) | Thermo Fisher | PICM0-3050 | |
| Basal Medium Eagle | Invitrogen | 21010 | |
| Earle s Balanced Salt Solution | Sigma | E2888 | |
| Horse serum | Invitrogen | 26050-088 | |
| Glutamax | Invitrogen | 35050 | |
| Gentamicin | Invitrogen | 15710-064 | |
| Fungizone | Invitrogen | 15295 | |
| D-glucose | Sigma | G8769 | |
| BSL-1 fume hood | Baker | ||
| McIlwain tissue chopper | Brinkmann | ||
| Teflon disks | Brinkmann | 023-49-310-1 | |
| Spatula | Thermo Fisher | 14-373-25A | |
| Curved iris scissors | Fine Science Tools | 14091-09 | |
| Long straight scissors | Fine Science Tools | 14002-14 | |
| Long forceps | Thermo Fisher | 13-812-40 | |
| Angled forceps | Fine Science Tools | 11808-02 | |
| Short forceps | Thermo Fisher | 13-812-38 | |
| #5 Inox forceps | Fine Science Tools | 11254-20 | |
| 2 Iris spatulae | Fine Science Tools | 10094-13 | |
| 150 x 15 mm Petri dishes | Thermo Fisher | 08-757-148 | |
| 60 x 15 mm Petri dishes | Thermo Fisher | 08-757-100B | |
| Wild M8 stereomicroscope | Wild Heerbrugg | ||
| Gey s balance salt solution | Sigma | G9779 | |
| Blak-Ray shortwave Ultraviolet measuring meter | UVP | J-225 | |
| 6-well Falcon culture dishes | Thermo Fisher | 08-772-1B | |
| Neurobasal | Invitrogen | 21103 | |
| B27 supplement | Invitrogen | 17504 | |
| Gem21 Neuroplex | Gemini Bioproducts | 400-160-010 | |
| Ascorbic acid | Sigma | A4544 | |
| CO2 Analyzer | Bacharach | #2820 |
Pre-screening for Vitality of Slice Cultures
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| Sytox Green | Invitrogen | S7020 | |
| DMIBRE inverted microscope | Leica |
Cold-Preconditioning
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| BSL-2 Fume Hood | NuAire |
Excitotoxic Injury
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| CoolSnap fx CCD camera | Photometrics | ||
| Fluoroscein | Invitrogen | F36915 | |
| MetaMorph software | Molecular Devices | v. 7.5.04 | |
| 100 μm deep hemacytometer | Hausser Scientific | ||
| N-methyl-D-aspartate | Calbiochem | 454575 | |
| SigmaStat software | Systat Software Inc. | v. 3.5 |
Co-treatments applied with Cold-Preconditioning
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| sTNFR1 | R & D Systems | 425-R1-050 | |
| Bovine Serum Albumin | Sigma | A-4503 |
RNA Isolation
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| RNAlater | Ambion | AM7021 | |
| Micro RNEasy Kit | Qiagen | 74004 | |
| β-mercaptoethanol | Fisher | 03446-100 | |
| Diposable 1.5 RNAse-free Pestle |
South Jersey Precision Tool and Mold, Inc. | 749521-1590 | |
| RNasin | Promega | N261A | |
| Tris[hydroxymethyl]aminomethane | Sigma | T3069 | |
| EDTA (ethylenediaminetetraacetic acid disodium salt hydrate | Sigma | #E7889 |
RNA Quantification
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| RiboGreen Assay | Invitrogen | R11491 | |
| Yeast tRNA | Invitrogen | 15401-011 | |
| 1.5 mL centrifuge tubes | USA Scientific | 16155500 | |
| 96-well fluorescent assay plate | Nunc | DK-4000 | |
| 96-well fluorescent plate reader | Tecan | Safire II |
Quantitative PCR
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| iScript reverse transcription kit | Bio-Rad | 170-8891 | |
| SYBR Green | Invitrogen | S7563 | |
| Platinum Taq polymerase | Invitrogen | RNA Ultrasense 11732-927 | |
| iCycler thermocycler | Bio-Rad | iCycler Optical Module | |
| iCycler system software | Bio-Rad | v. 3.1 |
Quantitative PCR for Microarrays
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| RNase Away | Molecular BioProducts | #7000 | |
| RT2 First Strand Kit | SABiosciences | C-03 | |
| SYBR Green-based PCR mix | SABiosciences | PA-011 | Specific for iCycler |
| RT2 Profiler PCR Array | SABiosciences | PARN-011A |
Proteomic Assay
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| Cell lysis kit | Bio-Rad | 171-304011 | |
| Microcentrifuge | Fisher Scientific | Micro 7 | |
| BSA protein stock | Bio-Rad | 500-0007 | |
| BCA protein assay kit | Thermo Scientific | 23225 | |
| Immuno 96 MicroWell plates | Nunc | 449824 | |
| Sealing tape | Bio-Rad | 2239444 | |
| 96-well plate reader | Perkin Elmer | 1420-mulilabel counter | |
| Bioplex Rat TNF-α cytokine assay | Bio-Rad | X0000001T |
Immunostaining
| Name of Reagent/Equipment | Company | Catalogue/Model Number | Comments |
| 16% Paraformaldehyde | Alfa Aesar | 43368 | |
| Lysine | Sigma | L-6001 | |
| Sodium phosphate | Fisher Scientific | S374-1 | |
| Sodium periodate | Sigma | S-1878 | |
| Sodium azide | Sigma | S-2002 | |
| Hydrogen Peroxide (30%) | Sigma | H1009 | |
| Goat serum | Colorado Serum Company | CS 0920 | |
| Triton X-100 | Sigma | T-8787 | |
| Staining dishes | Ted Pella, Inc. | 14511 | |
| Plate Shaker | Lab-Line Instruments, Inc. | 3520 | |
| #1 Filter Papers (185 mm) | Whatman | 1001-185 | |
| 3,3 -diaminobenzidine | Sigma | D8001 | |
| Dimethyl sulfoxide | Sigma | D8418 | |
| Ethanol | Pharmco-AAPER | 111000200 | |
| Xylene | Fisher Scientific | X3S-4 | |
| Permount mounting media | Fisher Scientific | SP15-100 | |
| Cryostat | Leica | cm3050 S | |
| Tissue-Tek | Ted Pella, Inc. | 27050 | |
| Fine-tip paint brush | Ted Pella | 11806 | |
| PAP blocking pen | Ted Pella, Inc. | 22309 | |
| SFX signal enhancer | Invitrogen | A31631 | |
| ProLong Antifade | Invitrogen | P7481 |
Riferimenti
- Aptowicz, C. O., Kunkler, P. E., Kraig, R. P. Homeostatic plasticity in hippocampal slice cultures involves changes in voltage-gated Na+ channel expression. Brain Res. 998, 155-163 (2004).
- Beattie, E. C. Control of synaptic strength by glial TNFalpha. Science. 295, 2282-2285 (2002).
- Breder, C. D., Dewitt, D., Kraig, R. P. Characterization of inducible cyclooxygenase in rat brain. J Comp Neurol. 355, 296-315 (1995).
- Caggiano, A. O., Breder, C. D., Kraig, R. P. Long-term elevation of cyclooxygenase-2, but not lipoxygenase, in regions synaptically distant from spreading depression. J Comp Neurol. 376, 447-462 (1996).
- Caggiano, A. O., Kraig, R. P. Eicosanoids and nitric oxide influence induction of reactive gliosis from spreading depression in microglia but not astrocytes. J Comp Neurol. 369, 93-108 (1996).
- Caggiano, A. O., Kraig, R. P. Prostaglandin E2 and 4-aminopyridine prevent the lipopolysaccharide-induced outwardly rectifying potassium current and interleukin-1beta production in cultured rat microglia. J Neurochem. 70, 2357-2368 (1998).
- Caggiano, A. O., Kraig, R. P. Prostaglandin E receptor subtypes in cultured rat microglia and their role in reducing lipopolysaccharide-induced interleukin-1beta production. J Neurochem. 72, 565-575 (1999).
- Calabrese, E. J. Drug therapies for stroke and traumatic brain injury often display U-shaped dose responses: occurrence, mechanisms, and clinical implications. Crit Rev Toxicol. 38, 557-577 (2008).
- Calabrese, E. J. Biological stress response terminology: Integrating the concepts of adaptive response and preconditioning stress within a hormetic dose-response framework. Toxicol Appl Pharmacol. 222, 122-128 (2007).
- Calabrese, E. J., Baldwin, L. A. Hormesis: the dose-response revolution. Annu Rev Pharmacol Toxicol. 43, 175-197 (2003).
- Hansel, N. N. Analysis of CD4+ T-cell gene expression in allergic subjects using two different microarray platforms. Allergy. 63, 366-369 (2008).
- Hulse, R. E., Kunkler, P. E., Fedynyshyn, J. P., Kraig, R. P. Optimization of multiplexed bead-based cytokine immunoassays for rat serum and brain tissue. J Neurosci Methods. 136, 87-98 (2004).
- Hulse, R. E., Swenson, W. G., Kunkler, P. E., White, D. M., Kraig, R. P. Monomeric IgG is neuroprotective via enhancing microglial recycling endocytosis and TNF-alpha. J Neurosci. 28, 12199-12211 (2008).
- Hulse, R. E., Winterfield, J., Kunkler, P. E., Kraig, R. P. Astrocytic clasmatodendrosis in hippocampal organ culture. Glia. 33, 169-179 (2001).
- Kraig, R. P. TNF-alpha and Microglial Hormetic Involvement in Neurological Health and Migraine. International Dose-Respose Society. , (2010).
- Kunkler, P. E., Hulse, R. E., Kraig, R. P. Multiplexed cytokine protein expression profiles from spreading depression in hippocampal organotypic cultures. J Cereb Blood Flow Metab. 24, 829-839 (2004).
- Kunkler, P. E., Hulse, R. E., Schmitt, M. W., Nicholson, C., Kraig, R. P. Optical current source density analysis in hippocampal organotypic culture shows that spreading depression occurs with uniquely reversing currents. J Neurosci. 25, 3952-3961 (2005).
- Kunkler, P. E., Kraig, R. P. Reactive astrocytosis from excitotoxic injury in hippocampal organ culture parallels that seen in vivo. J Cereb Blood Flow Metab. 17, 26-43 (1997).
- Kunkler, P. E., Kraig, R. P. Calcium waves precede electrophysiological changes of spreading depression in hippocampal organ cultures. J Neurosci. 18, 3416-3425 (1998).
- Kunkler, P. E., Kraig, R. P. P/Q Ca2+ channel blockade stops spreading depression and related pyramidal neuronal Ca2+ rise in hippocampal organ culture. Hippocampus. 14, 356-367 (2004).
- Lambertsen, K. L. Microglia protect neurons against ischemia by synthesis of tumor necrosis factor. J Neurosci. 29, 1319-1330 (2009).
- Lee, J. K. Regulator of G-protein signaling 10 promotes dopaminergic neuron survival via regulation of the microglial inflammatory response. J Neurosci. 28, 8517-8528 (2008).
- Mattson, M. P. Hormesis and disease resistance: activation of cellular stress response pathways. Hum Exp Toxicol. 27, 155-162 (2008).
- Ning, B. Systematic and simultaneous gene profiling of 84 drug-metabolizing genes in primary human hepatocytes. J Biomol Screen. 13, 194-201 (2008).
- Oppenheim, J., Feldman, M., Oppenheim, J. J., Feldman, M. . in Cytokine Reference. 1, (2001).
- Pfaffl, M. W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res. 29, e45-e45 (2001).
- Stellwagen, D., Beattie, E. C., Seo, J. Y., Malenka, R. C. Differential regulation of AMPA receptor and GABA receptor trafficking by tumor necrosis factor-alpha. J Neurosci. 25, 3219-3228 (2005).
- Stellwagen, D., Malenka, R. C. Synaptic scaling mediated by glial TNF-alpha. Nature. 440, 1054-1059 (2006).
- Streit, W. J. Microglia as neuroprotective, immunocompetent cells of the CNS. Glia. 40, 133-139 (2002).
- Wilde, G. J., Pringle, A. K., Sundstrom, L. E., Mann, D. A., Iannotti, F. Attenuation and augmentation of ischaemia-related neuronal death by tumour necrosis factor-alpha in vitro. Eur J Neurosci. 12, 3863-3870 (2000).

