Måling af mekaniske egenskaber af levende celler bruge Atomic Force Microscopy
Summary
Dette papir viser en protokol til at karakterisere de mekaniske egenskaber af levende celler ved hjælp af microindentation hjælp af en Atomic Force Microscope (AFM).
Abstract
Mekaniske egenskaber af celler og ekstracellulær matrix (ECM) spiller en vigtig rolle i mange biologiske processer, herunder stamceller differentiering, tumordannelse og sårheling. Ændringer i stivhed af celler og ECM er ofte tegn på ændringer i celle fysiologi eller sygdomme i væv. Derfor celle stivhed er et indeks for at vurdere forløbet af cellekulturer. Blandt de mange metoder, der anvendes til at måle stivheden af celler og væv, giver mikro-indrykning ved hjælp af en Atomic Force Microscope (AFM) en måde at pålideligt måle stivheden af levende celler. Denne metode har været almindeligt anvendt til at karakterisere mikroskala stivhed for en række forskellige materialer lige fra metaloverflader til blødt biologisk væv og celler. Det grundlæggende princip i denne metode er at indrykke en celle med en AFM spids valgte geometri og måle den påførte kraft fra bøjning af AFM cantilever. Montering af kraft-indrykning kurve til Hertz tilstandl for den tilsvarende spids geometri kan give kvantitative målinger af materiale stivhed. Dette papir viser proceduren for at karakterisere stivhed levende celler ved hjælp AFM. Vigtige trin, herunder processen med AFM kalibrering, force-kurve erhvervelse og dataanalyse ved hjælp af en Matlab rutine er påvist. Begrænsninger af denne metode er også drøftet.
Introduction
Mekaniske egenskaber, især stivhed, af individuelle celler og deres omgivende ekstracellulære matricer (ECM) er kritisk for mange biologiske processer, herunder cellevækst, motilitet, division, differentiering og vævshomeostase. 1. Det er blevet påvist, at celle mekanisk stivhed hovedsageligt bestemmes af cytoskelettet, især netværk af actin og intermediære filamenter og andre proteiner forbundet med dem. 2 Resultater fra mekaniske tests på in vitro netværk af actin og intermediære filamenter tyder på, at den celle mekanik er i høj grad afhængig af cytoskeletal struktur og pre-stress i cytoskelettet. 3-5 Stivhed af levende celler er derefter betragtes som et indeks til at evaluere cytoskeletal struktur 6, myosin aktivitet 7 og mange andre cellulære processer. Endnu vigtigere er ændringer i celle mekaniske egenskaber også ofte anset for at være tæt associeretbundet med forskellige sygdomstilstande såsom tumor dannelse og metastase 8-10 Overvågning den mekaniske stivhed levende celler kan derfor tilvejebringe en ny måde at overvåge celle fysiologi,. at opdage og diagnosticere sygdomme 8,. og vurdere effektiviteten af medicinsk behandling 11 , 12
Flere metoder, herunder partikel-sporing microrheology, 13-16 magnetisk vridning cytometri, 17 mikropipette aspiration 18,19 og microindentation 20-22 er blevet udviklet til at måle elasticiteten af cellerne. Partikel sporing microrheology sporer termiske vibrationer enten submikrone fluorescerende partikler injiceret ind i celler eller referencemærker markører inde i cellen cytoskeleton. 23. Elastiske og tyktflydende egenskaber af celler beregnes ud fra de målte partikel forskydninger ved hjælp af udsving-dissipation teorem. 14,23 Denne metode giver samtidige målinger af lokalmekaniske egenskaber med høj rumlig opløsning på forskellige steder i en celle. Dog kan injicere fluorescerende partikler i celler føre til ændringer i cellefunktion, cytoskeleton struktur og dermed Cellemekanik. Mikropipette aspiration metode gælder undertryk i en mikropipette med en diameter fra 1 til 5 m til at suge et lille stykke af cellemembranen ind i pipetten. Celle stivhed beregnes ud fra den anvendte undertryk og cellemembran deformation. 18. Denne fremgangsmåde kan imidlertid ikke detektere heterogen fordeling af stivhed over cellen. Magnetisk vride cytometri (MTC) gælder magnetfelt til at generere drejningsmoment på super paramagnetiske kugler knyttet til cellemembranen. 17. Cell stivhed er afledt i denne fremgangsmåde fra forholdet mellem den påførte drejningsmoment og vride deformation af cellemembranen. Det er vanskeligt at styre placeringen af magnetiske perler i MTC metoden, og det er også challenging at karakterisere vride deformation med høj opløsning. Microindentation anvender en indrykning med veldefineret geometri at punch ind i cellen. Den indrykke kraft, og den resulterende indrykning i celler ofte følger forudsigelsen af Hertz model. Youngs moduli af celler kan beregnes ud fra kraft-indrykning kurver ved at montere dem til Hertz model. Denne metode har været almindeligt anvendt til at teste de mekaniske egenskaber af væv og celler på trods af dens begrænsninger såsom usikkerhed i kontakt bestemmelse, anvendeligheden af Hertz-modellen, og potentialet fysisk skade cellerne. Blandt de mange enheder til microindentaion 20 er Atomic Force Microscope (AFM) kommercielt tilgængelige og har været almindeligt anvendt til at karakterisere mekaniske egenskaber af levende celler og væv 21,24-27.
Dette papir viser proceduren for anvendelse af en asyl MFP3D-Bio AFM til at karakterisere celle mekanik. AFM ikke påly giver høj opløsning topografi af celler, men også har været almindeligt anvendt til at karakterisere de mekaniske egenskaber af vævsceller. Princippet om AFM indrykning er illustreret i figur 1.. AFM cantilever nærmer cellen fra nogle få mikrometer ovenfor; kommer i kontakt med cellen, led cellen, således at cantilever nedbøjningen når et forvalgt setpunkt, og trækker sig væk fra cellen. Under denne proces cantilever afbøjningen registreres som en funktion af dens placering som vist i figur 1.. Før du foretager kontakt med cellen, bevæger cantilever i mediet uden nogen tilsyneladende afbøjning. Når indrykning på cellen, cantilever bøjninger og afbøjning signal stiger. Køreledningsophæng er modelleret som elastiske bjælker, så deres afbøjning er proportional med den kraft, der påføres cellen. Ved at indstille den maksimale cantilever afbøjning, er den maksimale størrelse af kraft, der påføres prøven begrænset for at undgå dAmage til celler. Den del af den kraft, kurve fra punkt b til punkt C i figur 1, hvor spidsen led ind i cellen, er egnet til den hertz model til at udtrække cellen stivhed.
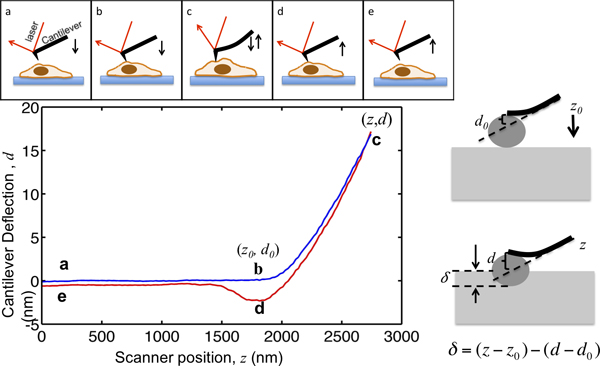
Figur 1. Illustration af AFM microindentation og fortolkning af kraftkurve. Det øverste panel viser bevægelsen af AFM cantilever drevet af piezo scanneren. Den lodrette placering af fritbærende z og cantilever afbøjning signalet d registreres under processen. Cantilever starter fra punkt a, nogle få mikrometer over cellen. Mens nærmer cellen, prøven indrykning δ forbliver nul, indtil den når punkt B, hvor spidsen kommer i kontakt med cellen. Koordinaterne for punkt B i plottet er kritiske værdiertil dataanalyse, der betegnes med (z 0, d 0>). Fra B til C, indtil cantilever led ind i cellen cantilever nedbøjningen når et sæt punkt, som er indstillet til at være forholdet mellem den tilsigtede maksimale indrykning kraft og cantilever fjederkonstant. Når udbøjningen signalet når den indstillede maksimale værdi, cantilever trækkes derefter tilbage fra cellen til punkt D, hvor det ofte trækkes nedad på grund af spids-prøve vedhæftning, frigøres fra cellen og vender tilbage til sin oprindelige placering på e. Højre panel illustrerer forholdet mellem fordybningen og den optagne z og d signal. I den nederste venstre panel er en afbildning af en repræsentativ kraft kurve, den maksimale indrykning af en fritbærende, hvoraf fjederkonstanten måles til at være 0.07N / m, er indstillet til at være 17 nm, således at den maksimale indrykning kraft, der udøves prøve er 1,2 nN. De vigtigste steder under indrykningen er markeret.
Protocol
Representative Results
Discussion
AFM indrykning metode har fordele ved at karakterisere mekaniske egenskaber af levende celler. Omend mindre følsomme end den magnetiske vride cytometri og optisk pincet, der kan måle kræfterne på piconewton level 32, kan AFM detektere modstanden kraft fra prøver spænder fra snesevis af pico-Newton til hundredvis af nano-Newton, der kan sammenlignes med spænde af kraft, kan anvendes til celler ved hjælp af en mikropipette 19.. Denne serie af force passer til de behov for at skabe målbare de…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker Dr. Paul Janmey ved University of Pennsylvania for at give cellelinjer, der anvendes i dette dokument. QW også erkende JF Byfield og Evan Anderson for deres indsigtsfulde diskussioner om AFM teknikker.
Riferimenti
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

