A Novel Stretching Platform for Applications i cellebiologi og Mechanobiology
Summary
Vi præsenterer i denne artikel en ny strækning platform, der kan anvendes til at undersøge en enkelt celle-responser til komplekse anisotrope biaksial mekanisk deformation og kvantificere de mekaniske egenskaber af biologisk væv.
Abstract
Værktøjer, der tillader anvendelse af mekaniske kræfter til celler og væv, eller der kan kvantificere de mekaniske egenskaber af biologisk væv har bidraget markant til forståelsen af grundlæggende mechanobiology. Disse teknikker er blevet flittigt brugt til at demonstrere, hvordan opståen og udvikling af forskellige sygdomme er kraftigt påvirket af mekaniske signaler. Denne artikel præsenterer en multi-funktionel biaksial stretching (BAXS) platform, der kan enten mekanisk stimulere enkelte celler eller kvantificere den mekaniske stivhed af væv. Den BAXS platformen består af fire svingspole motorer, der kan styres uafhængigt af hinanden. Enkelte celler kan dyrkes på et fleksibelt substrat, der kan knyttes til motorerne tillader en at eksponere cellerne for komplekse, dynamiske og rumligt varierende stamme felter. Omvendt, ved at inkorporere en kraft vejecelle, kan man også måle de mekaniske egenskaber af primære væv, som de er udsat for deformationscykler.I begge tilfælde skal en ordentlig sæt klemmer være konstrueret og monteret på BAXS platform motorer med henblik på at fast holde det fleksible substrat eller væv af interesse. Den BAXS platformen kan monteres på et inverteret mikroskop til at udføre samtidig transmitteret lys og / eller fluorescensimagografi at undersøge strukturelle eller biokemiske respons af prøven under stretching eksperimenter. Denne artikel indeholder eksperimentelle detaljer af designet og brugen af BAXS platform og præsenterer resultater for enkelt celle og hele væv studier. Den BAXS platform blev anvendt til at måle deformationen af kerner i en enkelt mus myoblastceller reaktion på substratet belastning og til at måle stivheden af isolerede muse-aorta. Den BAXS platform er et alsidigt værktøj, der kan kombineres med forskellige optiske microscopies for at give nye mechanobiological indsigt i de sub-cellulære, cellulære og hele vævsniveauer.
Introduction
Den mekaniske mikromiljø spiller en vigtig rolle i mange celle funktioner såsom proliferation, migration og differentiering, som har en dybtgående indvirkning på udviklingen og homeostase af væv og også i sygdomme 1-6. Gennem årene har et væld af eksperimentelle værktøjer blevet brugt til mekanisk at stimulere celler eller væv og måle mekaniske egenskaber af biologisk væv med målet om at øge vores forståelse af grundlæggende mechanobiology og studere opståen og udvikling af sygdomme 6-17. Dog skal man ofte bygger på flere forskellige eksperimentelle enheder for at nå målene for en bestemt undersøgelse. Denne artikel præsenterer en enkelt, multi-funktionelle, biaksial stretching (BAXS) platform, der giver mulighed for studier, der undersøger den rolle, mekaniske egenskaber og mekaniske kræfter spille i biologi på sub-cellulære til hele væv længdeskalaer. Den BAXS platformen ikke kun giver mulighed for quantification af de mekaniske egenskaber af isolerede væv, men også letter evnen til at anvende enkle, komplekse og dynamiske stamme felter levende celler for at forstå deres svar på strækning der sker in vivo. Den BAXS platformen også opretholder kapacitet til at udføre levende celle mikroskopi under mekanisk prøvning og forstyrrelser på celler og væv.
Den BAXS platform er en specialbygget apparat, der kan bruges til at undersøge effekten af substrat deformation på celleniveau og udføre belastningstest på biologiske væv (figur 1a). En aluminium varmelegeme blev fremstillet til at rumme en standard 10 cm petriskål og opretholde nogen fysiologiske opløsninger ved 37 ° C med en temperaturregulator og Kapton varmeapparater (Figur 1B). Denne BAXS platform kan integreres på en omvendt fase kontrast og / eller fluorescens mikroskop og giver mulighed for samtidig billeddannelse (figur 1C).Kort fortalt BAXS platform består af fire lineære svingspole motorer, hvoraf de bevægelige dele er monteret på miniature lineær bevægelse kuglelejer orienteret langs to vinkelrette akser (figur 1D). En lineær positionering trin er monteret på hver af de fire motorer til at tillade lodret bevægelse af klemmemekanismen, der skal anvendes (fig. 1E). Positionen af hver motor overvåges af en optisk encoder med en opløsning på 500 nm (figur 1F). Alle fire motorer styres selvstændigt med en motion controller, der anvender optisk encoderfeedback at udføre motion kommandoer (Figur 1G). En LabVIEW interface giver fuld kontrol over størrelsen forskydning, hastighed og acceleration af hver motor for at frembringe helt tilpasselig, statisk og dynamisk, deformation af celler eller vævsprøver.
Den teknik, der anvendes til at fremkalde en deformation i celler opnås ved blot allowing celler til fast holde sig til en fleksibel og gennemsigtig substrat og derefter strække dette substrat ved hjælp af de fire motorer i BAXS platformen. Den BAXS platform giver mulighed for montering af enhver specialdesignede sæt klemmer til at fastgøre underlaget på spolen motorer. Til dette formål har vi udviklet et sæt af klemmer, som en fleksibel og transparent substrat, lavet af polydimethylsiloxan (PDMS), kan fastgøres (figur 2A-C og figur 3). Da klemmerne vil blive udsat for fysiologiske opløsninger blev alle dele fremstillet af rustfrit stål for at muliggøre sterilisering. Disse klemmer er blevet omhyggeligt designet til at bringe underlaget så tæt som muligt til mikroskopet til formål at forbedre billedkvaliteten samtidig minimere stress på substratet under strækning (figur 2D).
Det samme BAXS platformen kan også anvendes til at kvantificere stivheden af små vævsprøver ved hjælp af et passende sæt af klemmer med tilpasTED understøtter de vævsprøver og en vejecelle til at overvåge kræfter. Kan tages flere tilgange til at montere et væv til BAXS platform motorer; i dette tilfælde rustfrit stål insekt minutiens pins kan tilslutte gennem åbningen af vaskulære væv med henblik på at udføre trækforsøg (4A-B). Alternativt, for tykke væv uden en naturlig åbning, væv kanter kan enten holdes på plads med klemmer knyttet til svingspolen motorer eller limet til små glasplader med biologisk lim og knyttet til motorer med klemmerne. For at udføre trækprøver en miniature vejecelle er påkrævet, og let kan inkorporeres onto BAXS platform motorer og anvendes til at måle den kraft, der virker på vævet under en strækning cyklus (figur 4C). Som BAXS platformen består af fire motorer, indførelse af en anden vejecelle gør det muligt at udføre trækprøvning langs to ortogonale retninger. Denne evne gør det muligt at quantify den mekaniske stivhed af et enkelt væv langs to vinkelrette retninger i det samme eksperiment.
Vigtigere er det, i alle konfigurationer, cellerne eller vævsprøverne af interesse altid holdes i en temperatur-kontrolleret bad, der er tilgængeligt for brugeren. Denne evne gør det muligt for indførelse af farmakologiske midler under prøven strækning med henblik på at undersøge den tidsmæssige respons af prøven. Derudover, da den optiske akse i den omvendte mikroskop forbliver uhindret, alle former for mikroskopi er stadig til rådighed for brugeren. Endelig, som alle fire motorer af BAXS platformen er uafhængige, er det muligt at anvende meget konfigurerbar stamme felter til prøven af interesse. In vivo celler og væv er udsat for komplekse og anisotropisk strækning der kan være mere passende efterlignede i denne platform i modsætning til traditionel enaksede stretching platform 7,13,15,18,19. Desuden de fysiske karakteristikaaf stammen felt kan ændres på flue under et forsøg. Disse evner tillader brugeren at undersøge celle-og vævsniveau svar på en lang række yderst kompliceret, anisotrop tidsmæssigt og rumligt varierende stamme felter. Denne artikel beskriver de fordele og begrænsninger af BAXS platformen samt dens design, drift principper, og de eksperimentelle oplysninger om enkelt celle og hele væv eksperimenter.

Fig. 1. Oversigt over BAXS platformen. A) Øverste visning af BAXS platformen viser fire svingspole motorer. B) detaljeret billede af petriskålen varmelegeme anvendes til at opretholde celler og væv ved 37 ° C. C) Platformen kan monteres på et inverteret mikroskop til at udføre levende cell imaging under stretching eksperimenter.D) detaljeret billede af svingspolemotor; den bevægelige del af platformen. E), detaljeret billede af den lineære positionering scenen så den lodrette forskydning af opspændingssystemet. F) detaljeret billede af den optiske encoder, der giver real-time position motoren til motion controller. G) detaljeret billede af bevægelses-controlleren viser de fire optiske encoderindgange og magt udgange til de fire svingspole motorer.
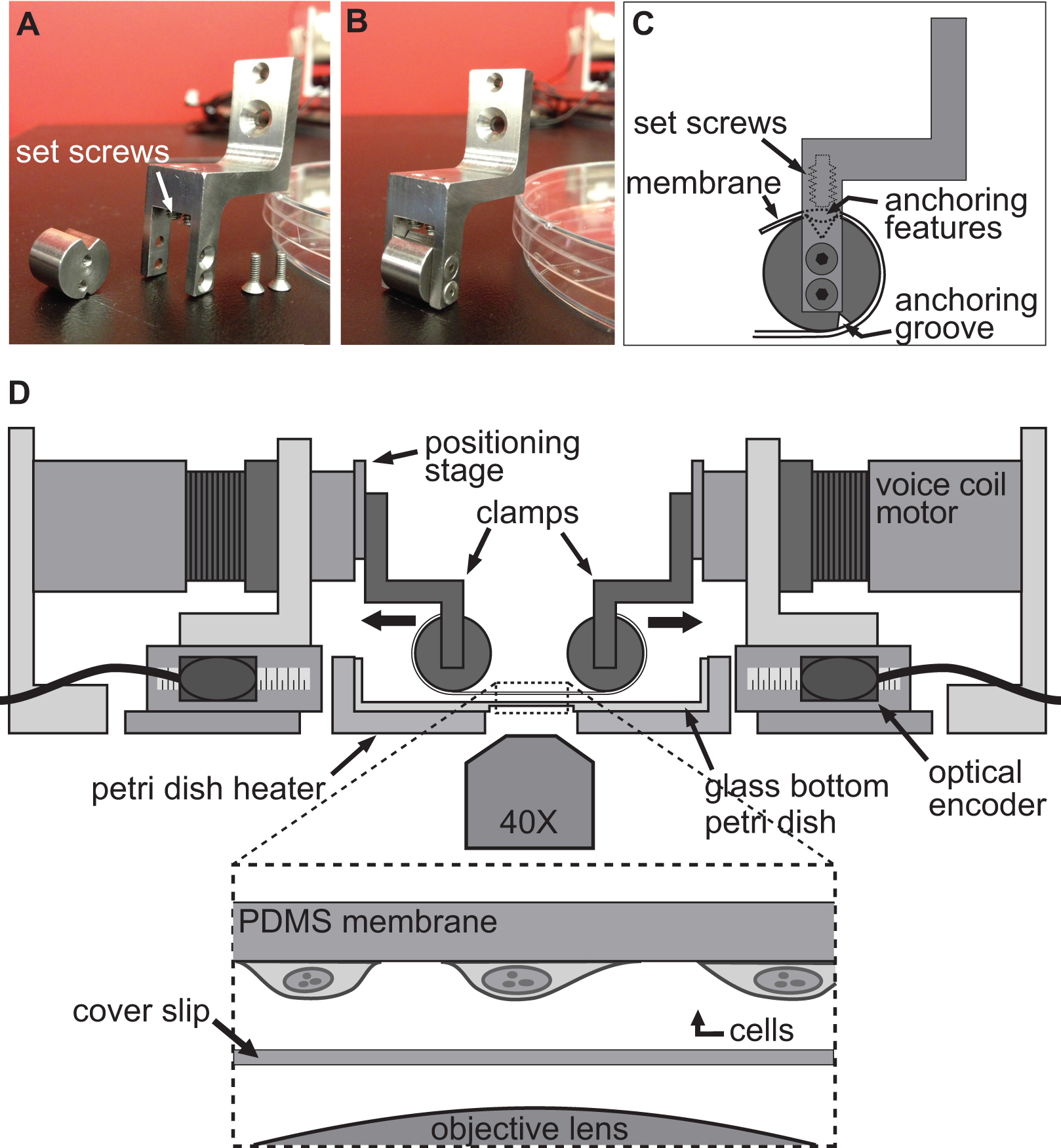
Figur 2.. Fastspændingssystem for celle strækker eksperimenter. AB) Billeder der viser detaljerne i de klemmer bruges til at fastgøre PDMS substrat til svingspolen motorer til at strække. C) Underlaget er viklet rundt om cylindriske del af klemmen med sin forankring features sidder i rillen på toppen. Derefter underlaget er sikret ved hjælp af stilleskruerne, der skubber underlaget / forankring elementer i det øverste rille. D) Illustration af BAXS platform med klemmerne holder underlaget på plads. Det indsatte viser en detaljeret afbildning af substratet med celler knyttet til den sidder lige over et dækglas og mikroskop mål.
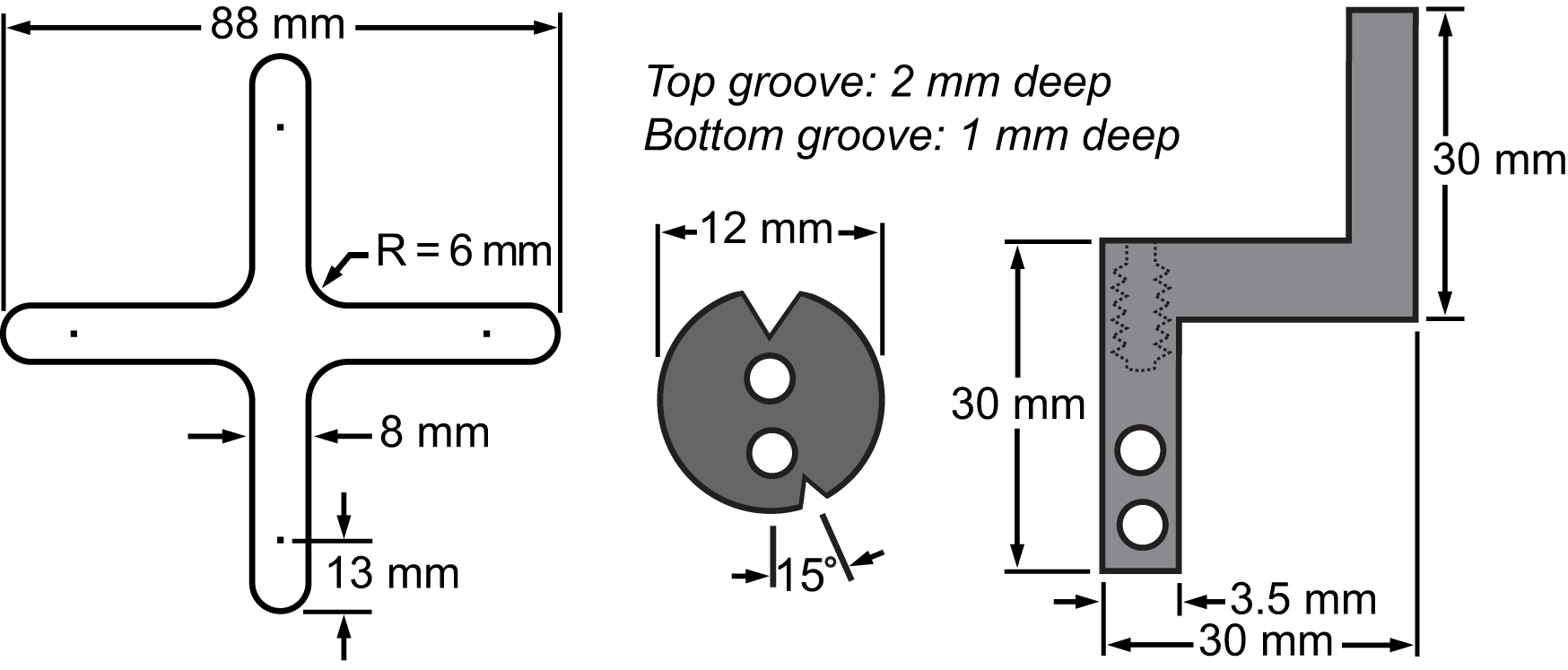
Figur 3.. Bill af materialer af membranen og dens fastspændingssystem. Tegninger, der viser dimensionerne af de vigtigste dele integreret i biaksial platform til at udføre celle stretching eksperimenter.
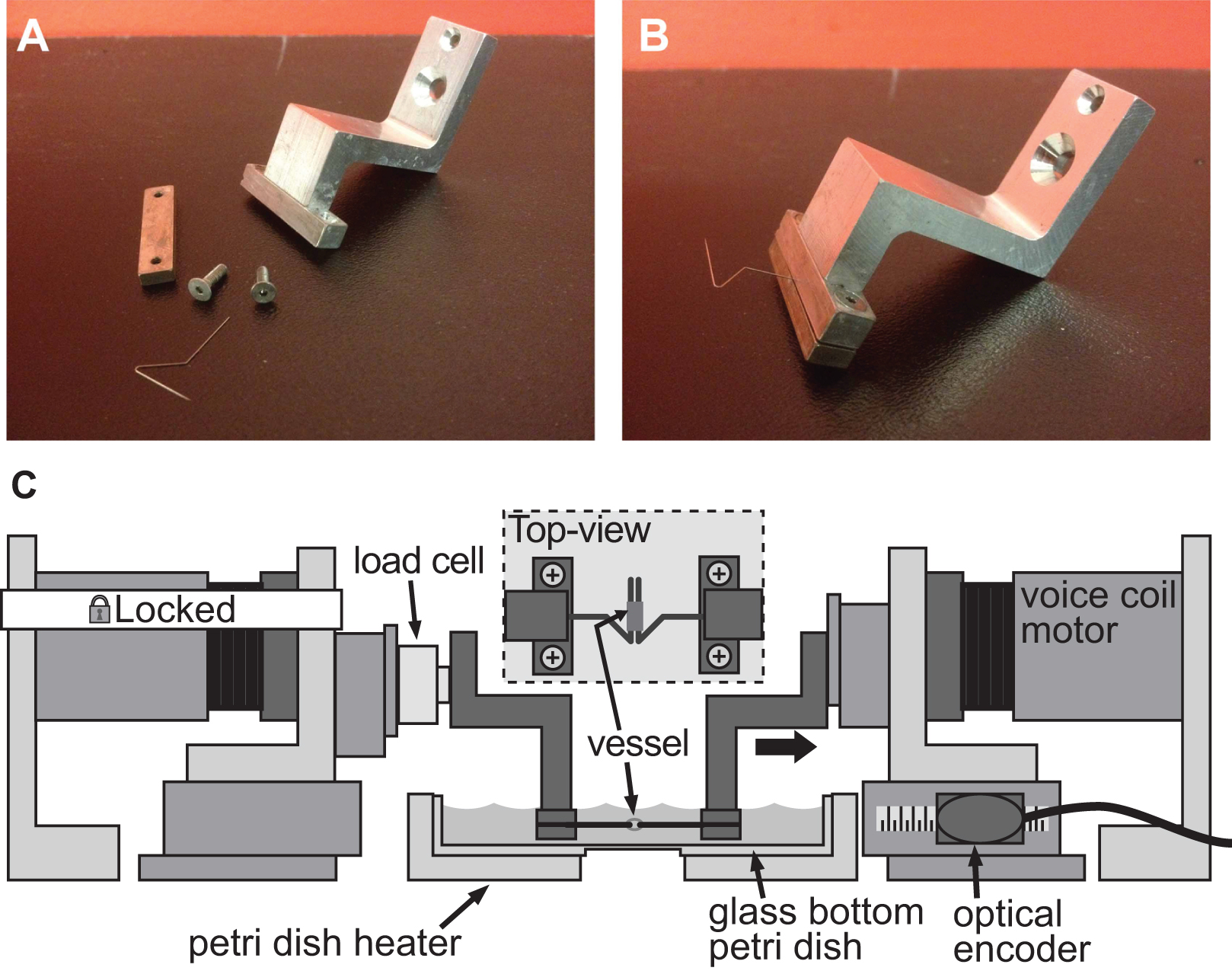
Figur 4.. Exrigelig af et fastspændingssystem for stivhed vurdering af små kaliber fartøjer. AB) detaljerede billeder af spændeenhedens anvendes til at fremkalde deformation i en 1 mm diameter mus aorta. Rustfri stifter blev omhyggeligt formet i åbne trekanter for at tillade skibet at glide på begge ben. C) Illustration af BAXS platform med klemmerne holde skibet og en vejecelle fastgjort mellem den faste motor og venstre klemme. Det indsatte viser en detaljeret top-fartøjet monteret på ben.
Protocol
Representative Results
Discussion
Den BAXS platform præsenteres her letter talrige eksperimenter i studiet af mechanobiology, fra undersøgelser af enkelte celler til hele væv. Hertil kommer, at platformen er meget fleksibel og konfigurerbar, giver mulighed for en lang række mekaniske stimulation eksperimenter og multiaksial trækprøvning. Platformen giver også mulighed for vedligeholdelse af celler og væv i fysiologiske betingelser, og giver mulighed for samtidig mikroskopi under stretching eksperimenter. De to eksperimenter, der er beskrevet i d…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
DT blev understøttet af en postdoc studentship fra Le Fonds de Recherche du Québec-Nature et Technologies (FQRNT) og en MITACS Elevate Strategisk Fellowship. CMC blev understøttet af en postdoc studentship fra le Fonds de Recherche en Santé du Québec (FRSQ) og Ernest og Margaret Ford kardiologi begavet forskning stipendium fra University of Ottawa Heart Institute. EOB blev støttet af driftstilskud MOP80204 fra den canadiske Institute for Health Research (CIHR) og T6335 fra hjertet og slagtilfælde Foundation of Ontario. CIHR og Medtronic tilsammen danner EOB med en peer-reviewed Research Chair (URC # 57093). AEP er finansieret af naturvidenskab og Engineering Research Council (NSERC) Discovery Grant, et Supplement NSERC Discovery Accelerator og taknemmelig støtte fra Canada Research Stole (CRC) program og en tidlig Researcher Award fra provinsen Ontario.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
Riferimenti
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

