A Novel Stretching plattform for applikasjoner i celler og vev mechanobiology
Summary
Vi presenterer i denne artikkelen en ny strekking plattform som kan brukes til å undersøke enkelt celle responser på komplekse anisotrop biaksial mekanisk deformasjon og kvantifisere de mekaniske egenskapene til biologiske vev.
Abstract
Verktøy som tillater anvendelse av mekaniske krefter på celler og vev, eller som kan kvantifisere de mekaniske egenskapene til biologiske vev har bidratt betydelig til forståelsen av basis mechanobiology. Disse teknikkene har vært mye brukt for å demonstrere hvordan utbruddet og progresjon av ulike sykdommer er sterkt påvirket av mekaniske signaler. Denne artikkelen presenterer en multi-funksjonelle biaksiale stretching (BAXS) plattform som kan enten mekanisk stimulere enkeltceller eller kvantifisere mekanisk stivhet av vev. Den BAXS plattformen består av fire talespole motorer som kan styres uavhengig av hverandre. Enkeltceller kan kultiveres på et fleksibelt substrat som kan festes til motorene tillater en å eksponere cellene til komplekse, dynamiske, og rommessig varierende belastningsfelt. Omvendt, ved å inkorporere en kraft som lastcelle, kan man også beregne de mekaniske egenskapene til primær-vev som de er utsatt for deformasjon sykluser.I begge tilfeller må et passende sett av klemmene være utformet og montert på BAXS plattform motorer for å holde fast det fleksible substrat eller vev av interesse. Den BAXS plattformen kan monteres på en invertert mikroskop for å utføre simultan fallende lys og / eller fluorescens-avbildning for å undersøke de strukturelle og biokjemiske reaksjon av prøven i løpet av strekkforsøk. Denne artikkelen gir eksperimentelle detaljene i utformingen og bruken av BAXS plattformen og presenterer resultater for enkelt celle og hele vev studier. Den BAXS plattformen ble brukt til å måle deformasjon av kjerner i enkelt mus myoblast-cellene i respons til underlaget belastning og for å måle stivheten av isolerte mus aortas. Den BAXS plattformen er en allsidig verktøy som kan kombineres med en rekke optiske microscopies for å tilveiebringe nye mechanobiological innsikt i de sub-cellulære, cellulær og hel vevsnivåer.
Introduction
Den mekaniske mikromiljøet spiller en viktig rolle i mange cellefunksjoner, som proliferasjon, migrering og differensiering, som har en betydelig innflytelse på utvikling og homeostase av vev, og også i sykdommer 1-6. Gjennom årene har en rekke eksperimentelle verktøy blitt brukt til mekanisk stimulere celler eller vev og måle mekaniske egenskapene til biologiske vev med mål om å øke vår forståelse av grunnleggende mechanobiology og studere utbruddet og progresjon av sykdommer 6-17. Imidlertid må man ofte avhengige av flere ulike eksperimentelle enhetene for å oppnå målene i en bestemt studie. Denne artikkelen presenterer et enkelt multi-funksjonelle, dual-aksen strekker (BAXS) plattform, som gjør det mulig for studier som undersøker den rollen som mekaniske egenskaper og mekaniske krefter spille i biologi ved sub-mobilnettet til hele vev lengdeskalaer. Den BAXS plattformen ikke bare åpner for quantification av de mekaniske egenskapene til isolerte vev, men også forenkler muligheten til å bruke enkle, komplekse og dynamiske belastnings felt til levende celler for å forstå sine svar til strekking som skjer in vivo. Den BAXS plattformen opprettholder også kapasitet til å utføre live-cell mikros under mekanisk testing og forstyrrelser på celler og vev.
Den BAXS plattformen er en spesialbygd anordning som kan brukes for å undersøke effekten av substratet deformasjon på cellenivå, og å utføre strekk-tester av biologiske vev (Figur 1a). En aluminiumvarmeanordning ble fremstilt for å få plass til en standard 10 cm petriskål og opprettholde noen fysiologiske løsninger ved 37 ° C ved hjelp av en temperaturregulator og Kapton beredere (figur 1B). Denne BAXS plattformen kan integreres på en omvendt fasekontrast-og / eller fluorescens mikroskop og muliggjør simultan avbildning (figur 1C).I korte trekk består BAXS plattform av fire lineære talespole motorer hvorav de bevegelige delene er montert på miniatyr lineær bevegelse kulelager lysbilder orientert langs to vinkelrette akser (figur 1D). En lineær posisjonering stadium er montert på hver av de fire motorer for å tillate vertikal bevegelse av klemsystemet som skal brukes (figur 1E). Posisjonen til hver motor er overvåket av en optisk giver med en oppløsning på 500 nm (fig. 1F). Alle fire motorene styres uavhengig av hverandre med en bevegelseskontroller ansette optisk encoder tilbakemelding til å utføre bevegelseskommandoer (figur 1G). En LabVIEW grensesnitt gir full kontroll over omfanget forskyvning, hastighet og akselerasjon for hver motor for å generere helt tilpasses, statisk og dynamisk, deformasjon av cellene eller vevsprøver.
Den teknikk som brukes for å fremkalle en deformasjon i cellene er oppnådd ved ganske enkelt å allowing celler for å feste seg til en fleksibel og gjennomsiktig substrat, og deretter strekking av dette substrat ved hjelp av de fire motorene i BAXS plattformen. Den BAXS plattformen tillater montering av noen spesialdesignede sett med klemmer for å feste underlaget på talespole motorer. For dette formål utformet vi et sett av klemmer til hvilke en fleksibel og gjennomsiktig substrat, som består av polydimetylsiloksan (PDMS), kan festes (figurene 2A-C og figur 3). Ettersom klemmene vil bli utsatt for fysiologiske løsninger, alle deler maskinert av rustfritt stål for å gi rom for sterilisering. Disse klemmene har blitt nøye designet for å bringe underlaget så nært som mulig til mikroskop mål å forbedre bildekvaliteten, samtidig som belastningen på underlaget under stretching (figur 2D).
Den samme BAXS plattformen kan også brukes til å kvantifisere stivhet i små vevsprøver, med et passende sett av klemmer med tilpasted støtter for vevsprøver og en lastcelle for å overvåke krefter. Flere tilnærminger kan tas for å montere en vev til BAXS plattform motorer; i dette tilfelle rustfrie insekt minutiens nålene kan hekte gjennom åpningen i vaskulære vev for å utføre strekk-tester (Fig. 4A-B). Alternativt, for tykke vev uten en naturlig åpning, vev kanter kan enten holdes i posisjon med klemmene festet til talespole motorer eller limt til små glassplater med biologisk lim og festet til motorene med klemmene. For å utføre strekk-tester en miniatyr-lastcelle er nødvendig, og kan lett tas bort på BAXS plattformmotorer og benyttes for å måle kraft som virker på vevet under et strekk syklus (figur 4C). Som BAXS plattformen er sammensatt av fire motorer, innføring av en andre lastcelle gjør det mulig å utføre strekk-testing langs to ortogonale retninger. Denne evnen gjør det mulig å quantify den mekaniske stivhet av en enkelt vev langs to vinkelrette retninger i samme eksperiment.
Viktigere, i alle konfigurasjoner, cellene eller vevsprøver av interesse blir alltid opprettholdt i et temperaturkontrollert bad som er tilgjengelig for brukeren. Denne evnen gjør det mulig for innføring av farmakologiske midler i prøven som strekker seg for å undersøke tidsmessige reaksjon av prøven. I tillegg, som den optiske aksen til det inverterte mikroskop forblir uforstyrret, alle former for mikroskopi er fremdeles tilgjengelig for brukeren. Til slutt, som alle fire motorene i BAXS plattformen er uavhengige, er det mulig å anvende svært konfigurerbar belastningsfelt til prøven av interesse. In vivo-celler og vev er utsatt for komplekse og anisotrop strekking som kan være mer hensiktsmessig etterlignet i denne plattformen i motsetning til tradisjonell uniaxial strekker plattform 7,13,15,18,19. Dessuten, de fysiske egenskapeneav belastningen feltet kan endres på fly under et eksperiment. Disse egenskaper tillater at brukeren kan undersøke cellulær-og vevsnivå respons på et stort antall svært komplekse, anisotropisk, er tidsmessig og rommessig varierende belastningsfelt. Denne artikkelen beskriver de fordeler og begrensninger av BAXS plattform samt dens design, operasjonelle prinsipper, og de eksperimentelle detaljer for enkelt celle og hele vev eksperimenter.

Figur 1. Oversikt over BAXS plattformen. A) toppriss av BAXS plattform som viser de fire talespolemotorer. B) detaljert bilde av petriskålen varmeapparatet benyttes til å opprettholde celler og vev ved 37 ° C. C) Plattformen kan monteres på en invertert mikroskop for å utføre levende cell imaging under strekker eksperimenter.D) Detaljert bilde av talespolen motor; den bevegelige del av plattformen. E) detaljert bilde av den lineære posisjonstrinn som tillater vertikal forskyvning av klemmesystemer. F) detaljert bilde av den optiske giver som gir sanntid posisjonen av motoren til bevegelsesregulatoren. G) Detaljert bilde av bevegelseskontrolleren som viser de fire optiske enkoderinnganger og effekter til de fire talespole motorer.
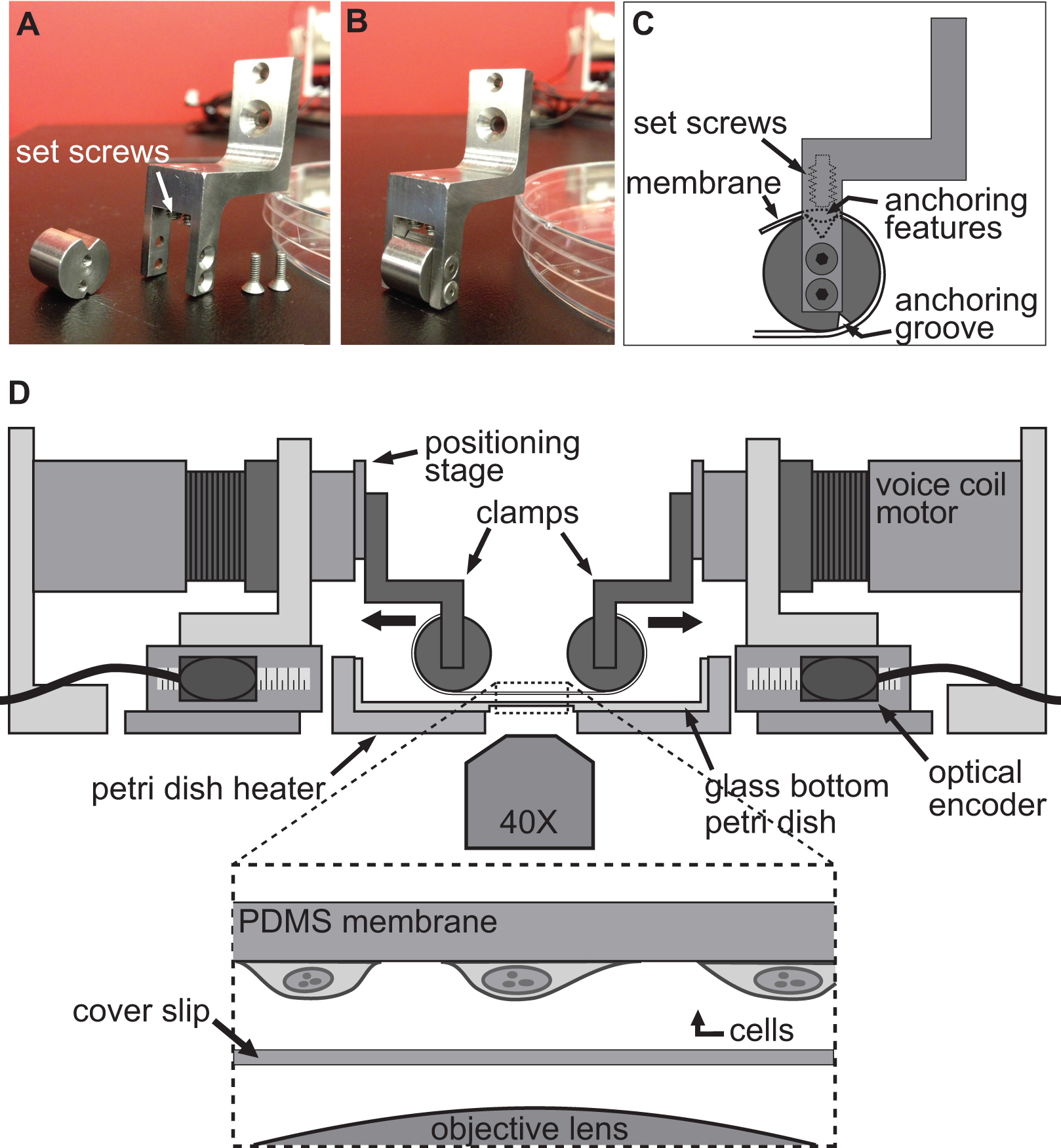
Figur 2. Klem system for celle strekker eksperimenter. AB) i bilder som viser detaljene av klemmer som brukes til å feste PDMS substrat til talespole-motorer for strekking. C) Substratet blir viklet rundt den sylindriske del av klemmen med dens forankring features sitter i sporet på toppen. Da underlaget er sikret ved hjelp av justeringsskruene som presser underlaget / forankring funksjoner inn i topp groove. D) Illustrasjon av BAXS plattform med klemmer som holder underlaget på plass. Det innfelte viser en detaljert visning av underlaget med celler som er knyttet til det sittende rett over et dekkglass og mikroskop mål.
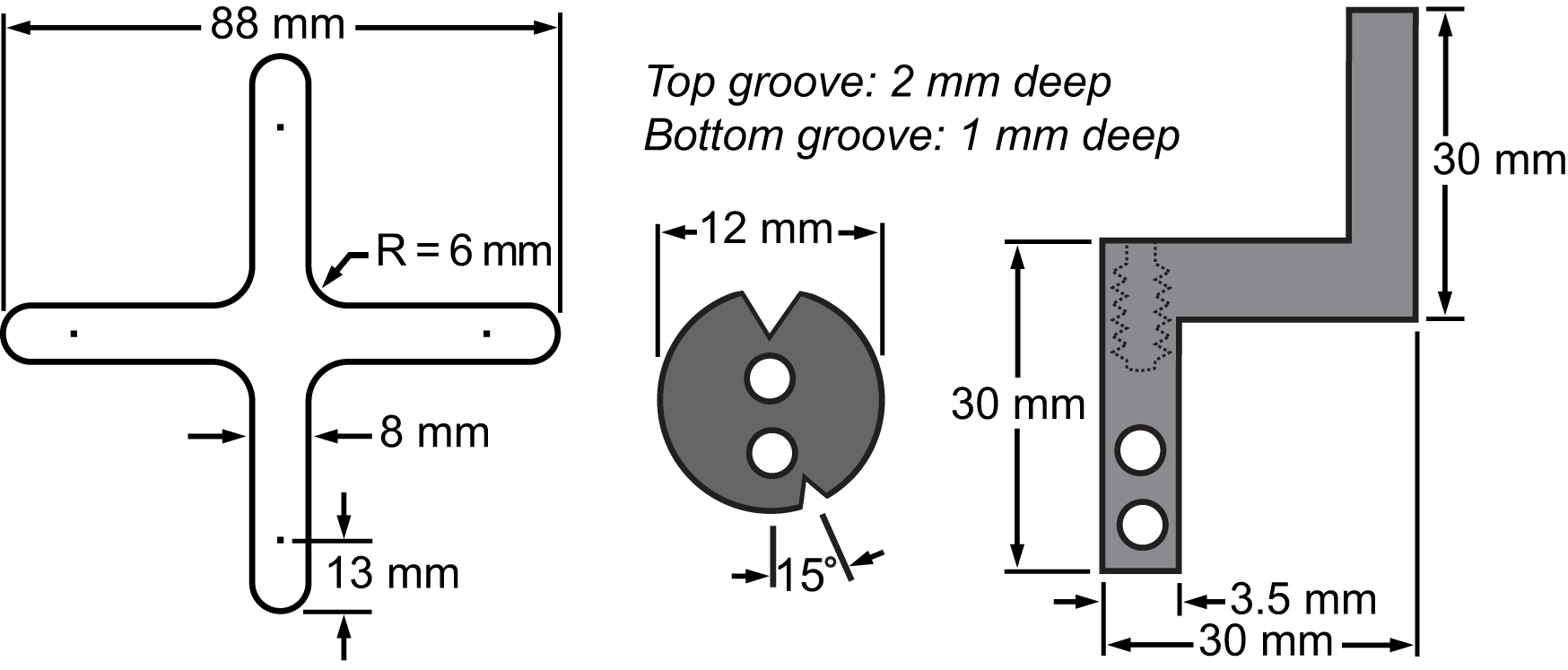
Fig. 3. Bill av materialer av membranen og dens klemsystemet. Tegninger som viser dimensjonene av de viktigste delene er integrert på biaksial plattformen for å utføre celle strekker eksperimenter.
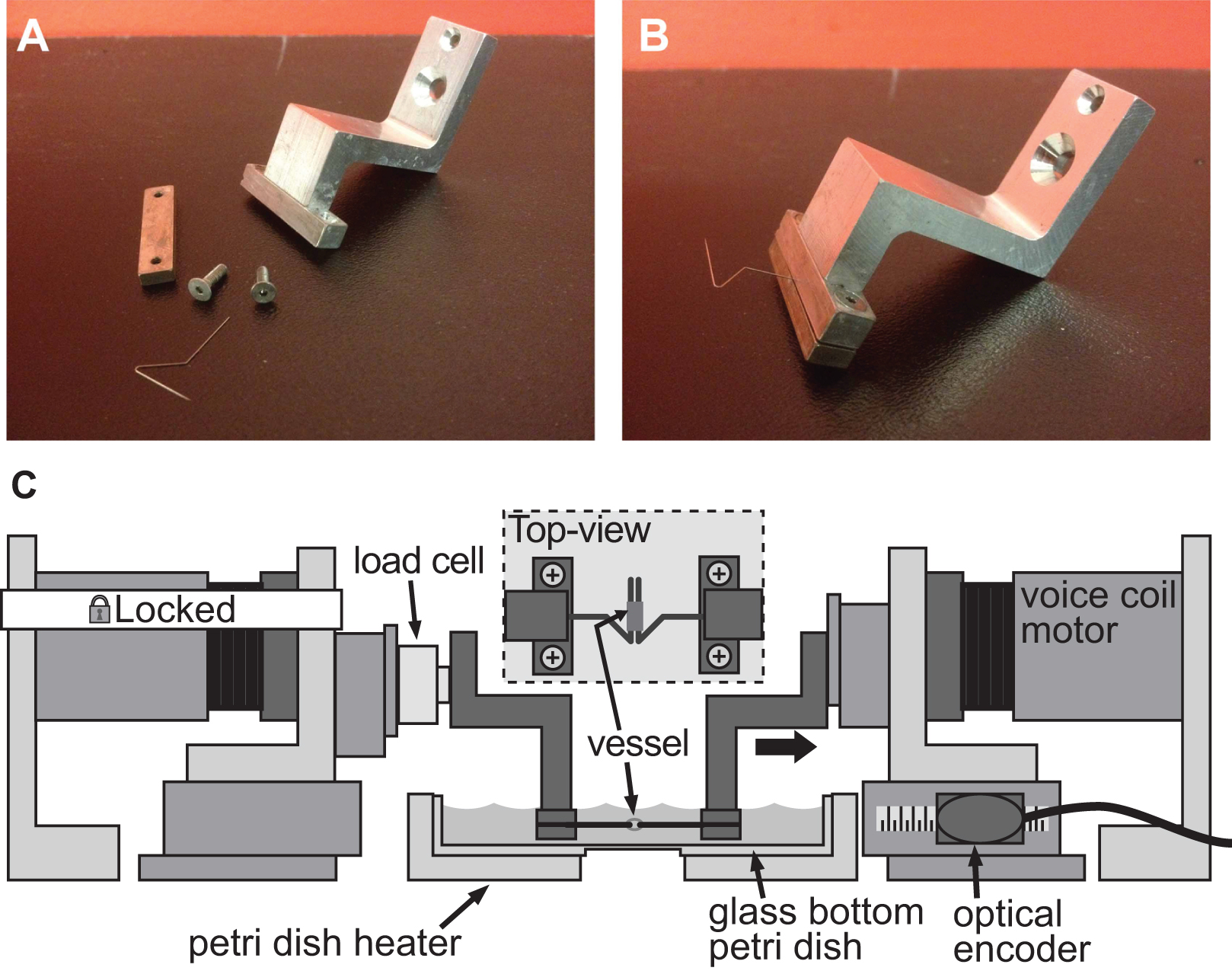
Figur 4. Exrikelig av et klemsystem for stivhet vurdering av småkalibrede fartøy. AB) detaljerte bilder av klemsystemet brukt til å indusere deformasjon i en 1 mm diameter mus aorta. Rustfritt stål nålene ble omhyggelig formet til åpne trekanter for å tillate fartøyet å gli på begge pinnene. C) Illustrasjon av BAXS plattform med klemmene som holder fartøyet og en lastcelle koblet mellom den faste motor, og den venstre klemme. Det innfelte viser et detaljert topp visning av montert på pinnene fartøy.
Protocol
Representative Results
Discussion
Den BAXS plattform som presenteres her muliggjør tallrike eksperimenter i studiet av mechanobiology, fra undersøkelser av enkeltceller til hele vev. I tillegg er plattformen svært fleksibel og konfigurerbar, slik at for en rekke mekaniske stimulering eksperimenter og multi-aksial strekkprøving. Plattformen muliggjør også vedlikehold av celler og vev i fysiologiske betingelser, og gir mulighet for samtidig mikroskopi under strekkforsøk. De to forsøkene som er beskrevet i forrige avsnitt viser allsidigheten til BA…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
DT ble støttet av en postdoktor studieplass fra le Fonds de recherche du Quebec-Nature et Technologies (FQRNT) og en MITACS Elevate Strategic Fellowship. CMC ble støttet av en postdoktor studieplass fra le Fonds de Recherche en Santé du Québec (FRSQ) og Ernest og Margaret Ford kardiologi begavet stipendiat ved Universitetet i Ottawa Heart Institute. EOB ble støttet av driftstilskudd MOP80204 fra Canadian Institute for Health Research (CIHR) og T6335 from the Heart og Stroke Foundation of Ontario. Den CIHR og Medtronic kollektivt gi EOB med en peer-reviewed Research Chair (URC # 57093). AEP er finansiert av naturvitenskap og Engineering Research Council (NSERC) Discovery Grant, en NSERC Discovery Accelerator Supplement og erkjenner takknemlig støtte fra Canada Research Stoler (CRC) program og en tidlig Forsker Award fra provinsen Ontario.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
Riferimenti
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

