A Novel Stretching plattform för tillämpningar inom cell-och vävnads mechanobiology
Summary
Vi presenterar i denna artikel en roman stretching plattform som kan användas för att undersöka en enda cell svar på komplexa anisotrop tvåaxlig mekanisk deformation och kvantifiera de mekaniska egenskaperna hos biologiska vävnader.
Abstract
Verktyg att tillåta tillämpning av mekaniska krafter på celler och vävnader, eller som kan kvantifiera de mekaniska egenskaperna hos biologiska vävnader har bidragit avsevärt till förståelsen av grund mechanobiology. Dessa tekniker har i stor utsträckning använts för att visa hur uppkomsten och utvecklingen av olika sjukdomar är starkt påverkade av mekaniska signaler. I denna artikel presenteras en multifunktionell biaxiell sträckning (BAXS) plattform som kan antingen mekaniskt stimulera enskilda celler eller kvantifiera den mekaniska stelhet i vävnader. Den BAXS plattformen består av fyra talspole motorer som kan styras oberoende av varandra. Enstaka celler kan odlas på ett flexibelt substrat som kan fästas på motorerna som tillåter en att utsätta cellerna för komplexa, dynamiska, och rumsligt varierande fält stam. Omvänt, genom att införliva en kraftbelastningscell, en kan även kvantifiera de mekaniska egenskaperna hos primära vävnader eftersom de är utsatta för deformation cykler.I båda fallen måste en ordentlig uppsättning klämmor konstrueras och monteras till BAXS plattformsmotorerna för att stadigt hålla det flexibla substrat eller vävnaden av intresse. Den BAXS plattform kan monteras på ett inverterat mikroskop för att utföra samtidig transmitterat ljus och / eller fluorescensavbildning för att undersöka den strukturella eller biokemiska svaret hos provet under stretching experiment. Den här artikeln innehåller experimentella uppgifter om utformning och användning av BAXS plattformen och presenterar resultat för enskild cell och hela vävnadsstudier. Den BAXS plattform användes för att mäta deformationen av kärnor i enstaka mus myoblastceller som svar till substrat-stam och för att mäta styvheten hos isolerade mus aortas. Den BAXS-plattformen är ett mångsidigt verktyg som kan kombineras med olika optiska microscopies för att tillhandahålla nya mechanobiological insikter på sub-cellulära, cellulär och hela vävnadsnivåer.
Introduction
Den mekaniska mikromiljön spelar en viktig roll i många cellfunktioner, t.ex. proliferation, migration och differentiering, som har en djupgående inverkan på utveckling och homeostas av vävnader och även i sjukdomar 1-6. Under årens lopp har en mängd experimentella verktyg använts för att mekaniskt stimulera celler eller vävnader och mäta mekaniska egenskaper hos biologiska vävnader med målet att öka vår förståelse av grundläggande mechanobiology och studera uppkomsten och utvecklingen av sjukdomar 6-17. Däremot måste man ofta bygga på flera olika experimentella enheter för att uppnå målen för en särskild undersökning. I denna artikel presenteras en enda multifunktionell, tvåaxlig stretching (BAXS) plattform som möjliggör studier som undersöker den roll som mekaniska egenskaper och mekaniska krafter spela i biologi på sub-cellulära till hela vävnad längdskalor. Den BAXS plattformen möjliggör inte bara för quantification av de mekaniska egenskaperna hos isolerade vävnader, men också underlättar möjligheten att tillämpa enkla, komplexa och dynamiska spänningsfält till levande celler för att förstå deras svar att stretching som sker in vivo. Den BAXS plattformen har även kapacitet att utföra live-cell mikroskopi under mekanisk provning och störningar på celler och vävnader.
Den BAXS-plattformen är en specialbyggd apparat som kan användas för att undersöka effekten av substrat deformation på cellnivå och utför dragprov på biologiska vävnader (Figur 1A). En aluminiumvärmare tillverkades för att rymma en standard 10-cm petriskål och behålla någon fysiologiska lösningar vid 37 ° C med hjälp av en temperaturregulator och Kapton värmare (Figur 1B). Denna BAXS plattformen kan integreras på en inverterad fas kontrast och / eller fluorescensmikroskop och möjliggör samtidig avbildning (Figur 1C).I korthet, det BAXS plattformen består av fyra linjära talspole motorer varav de rörliga delarna är monterade på miniatyr linjär rörelse kullagrade diabilder orienterade längs två vinkelräta axlar (Figur 1D). En linjär positionering skede är monterad på var och en av de fyra motorerna för att medge vertikal rörelse av fastspänningssystem som kommer att användas (figur 1E). Positionen för varje motor övervakas av en optisk kodare med en upplösning på 500 nm (figur 1F). Alla fyra motorerna oberoende kontrolleras med en spelkontroll med optisk pulsgivaråterkoppling för att utföra rörelsekommandon (figur 1G). En LabVIEW gränssnitt ger full kontroll över förskjutningen magnitud, hastighet och acceleration av varje motor för att generera helt anpassningsbara, statisk och dynamisk, deformation av celler eller vävnadsprover.
Tekniken som används för att inducera en deformation i celler uppnås genom att helt enkelt allowing celler att stadigt hålla sig till en flexibel och transparent substrat och sedan sträcka detta substrat med hjälp av de fyra motorerna i BAXS plattformen. Den BAXS plattformen möjliggör montering av alla skräddarsydda uppsättning klämmor för att fästa underlaget på röstspolen motorerna. För detta ändamål har vi utformat en uppsättning klämmor till vilka ett flexibelt och transparent substrat, tillverkade av polydimetylsiloxan (PDMS), kan fästas (Fig. 2A-C och fig. 3). Eftersom klämmorna kommer att utsättas för fysiologiska lösningar, alla delar bearbetad ur rostfritt stål för att medge sterilisering. Dessa klämmor är omsorgsfullt utformad för att ge underlaget så nära som möjligt till mikroskop målet att förbättra bildkvaliteten och samtidigt minimera belastningen på underlaget under sträckning (figur 2D).
Samma BAXS plattform kan också användas för att kvantifiera styvheten av små vävnadsprover, med användning av en lämplig uppsättning klämmor med adapted har stöd för vävnadsprover och en lastcell för att övervaka krafter. Flera metoder kan vidtas för att montera en vävnad till BAXS plattform motorer; i detta fall de rostfria insekts minutiens stift kan koppla genom öppningen av vaskulära vävnader i syfte att utföra dragprov (fig. 4A-B). Alternativt, för tjocka vävnader utan en naturlig öppning, vävnadskanter kan antingen hållas på plats med klämmorna knutna till talspole motorerna eller limmade till små glasskivor med biologisk lim och fästa vid motorer med klämmorna. För att utföra drag tester en miniatyr lastcell krävs och kan lätt införlivas på de BAXS plattforms motorer och används för att mäta den kraft som verkar på vävnaden under en sträckningscykel (Figur 4C). Såsom BAXS plattform består av fyra motorer medger införandet av en andra belastningscell en för att utföra dragprovning längs två ortogonala riktningar. Denna förmåga gör det möjligt för en att quantify den mekaniska styvheten hos ett enda vävnad längs två vinkelräta riktningar under samma försök.
Viktigt är i alla konfigurationer, cellerna eller vävnadsprov av intresse är alltid bibehållas i ett temperaturreglerat bad som är tillgängligt för användaren. Denna förmåga gör det möjligt för införandet av farmakologiska medel under prov sträckning för att undersöka det temporala svaret hos provet. Dessutom, eftersom den optiska axeln för inverterat mikroskop förblir intakt, alla former av mikroskopi är fortfarande tillgängliga för användaren. Slutligen, eftersom alla fyra motorer i BAXS plattformen är oberoende är det möjligt att tillämpa mycket konfigurerbara spänningsfält till provet av intresse. In vivo-celler och vävnader utsätts för komplexa och anisotropisk stretching som kan vara lämpligare härmade i denna plattform i motsats till traditionell enaxlig sträckning plattform 7,13,15,18,19. Dessutom är de fysikaliska egenskapernaav stammen fältet kan ändras i farten under ett experiment. Dessa förmågor tillåta användaren att undersöka den cellulära och vävnadsnivå som svar på ett stort antal mycket komplexa, anisotrop, tidsmässigt och rumsligt varierande spänningsfält. Denna artikel beskriver de fördelar och begränsningar av BAXS plattformen samt dess utformning, verksamhetsprinciper, och de experimentella detaljer för enskild cell och hela vävnadsexperiment.

Figur 1. Översikt av BAXS plattformen. A) Top bild av BAXS plattform som visar de fyra talspole motorer. B) Detaljerad bild av petriskålen värmare används för att upprätthålla celler och vävnader vid 37 ° C. C) Plattformen kan monteras på ett inverterat mikroskop för att spela live- cell imaging under stretching experiment.D) Detaljerad bild av talspolemotorn; den rörliga delen av plattformen. E) Detaljerad bild av den linjära positionerings scenen tillåter vertikal förskjutning av klämsystem. F) detaljerad bild av den optiska pulsgivare som ger realtidsläge för motorn till den rörelsekänsliga handkontrollen. G) Detaljerad bild av den rörelsekänsliga handkontrollen som visar de fyra optiska pulsgivaringångar och effekt till de fyra talspole motorer.
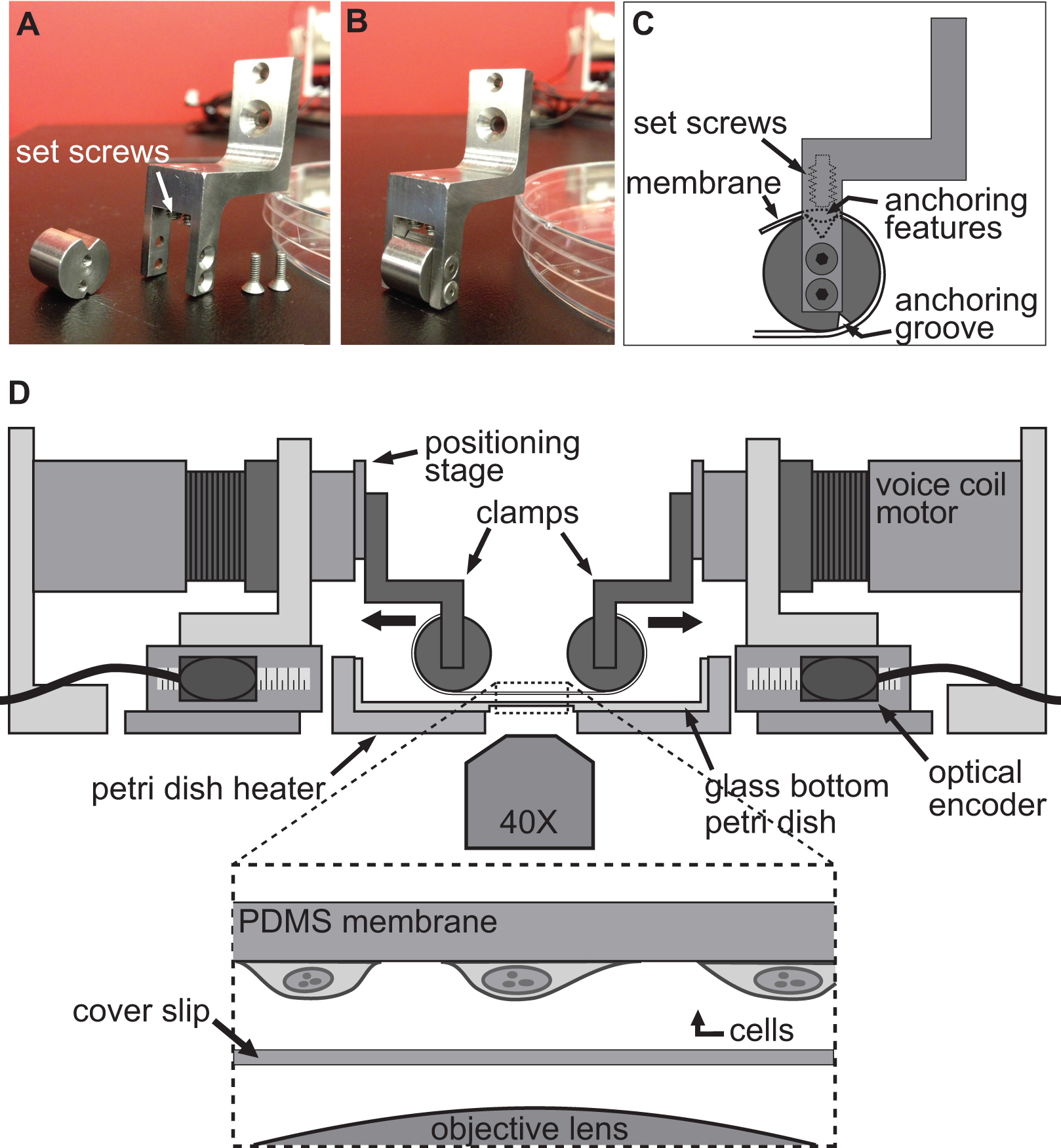
Figur 2. Kläm systemet för cell stretching experiment. AB) Bilder som visar detaljerna i klämmorna som används för att fästa PDMS substrat till talspole motorerna för stretching. C) Underlaget är virad runt den cylindriska delen av klämman med sin förankring features sitter i spåret på toppen. Då underlaget är säkrad med hjälp av ställskruvarna som driver substrat / förankring funktioner i det övre spåret. D) Illustration av BAXS plattform med klämmorna som håller underlaget på plats. Den infällda bilden visar en detaljerad vy av substratet med celler som är anslutna till den som sitter strax ovanför ett täckglas och mikroskopobjektivet.
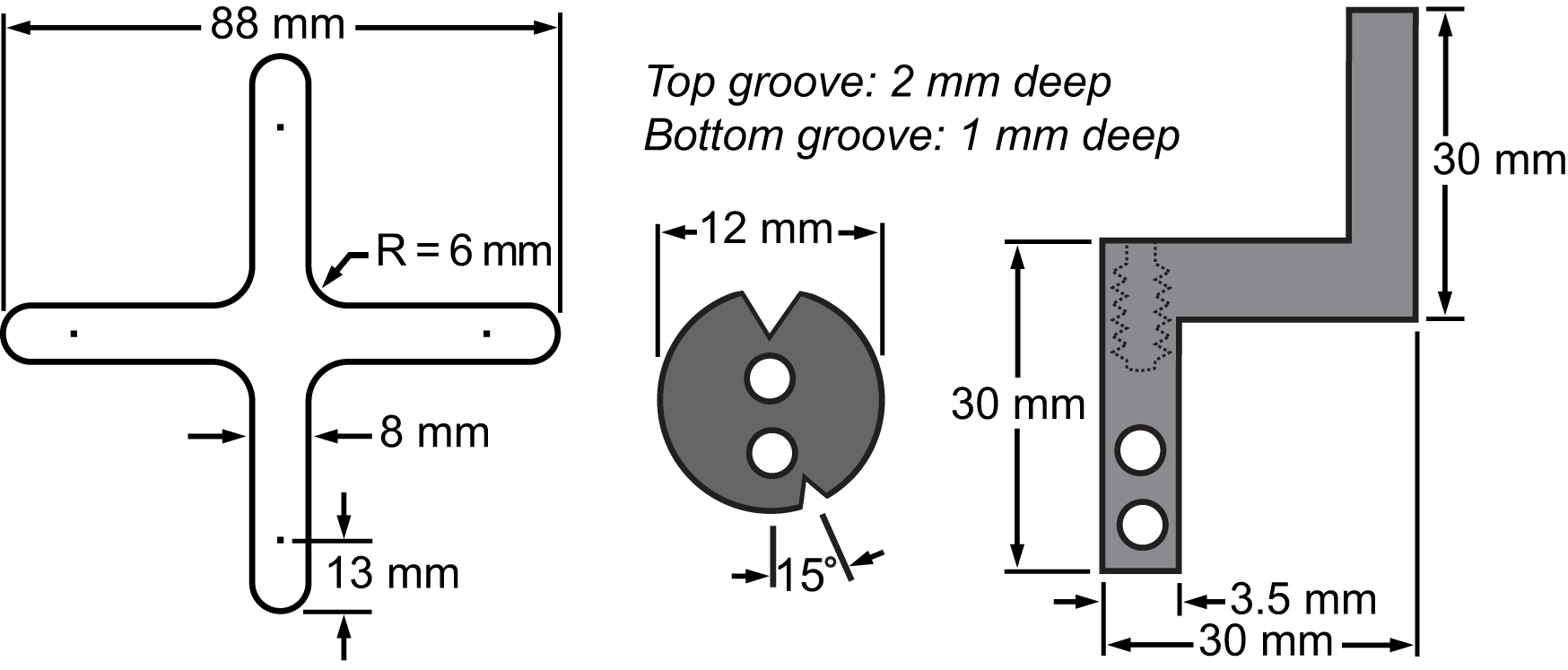
Figur 3. Bill av material av membranet och dess fastspänningssystem. Ritningar som visar dimensionerna hos huvuddelarna integreras till den biaxiella plattform för att utföra cell stretching experiment.
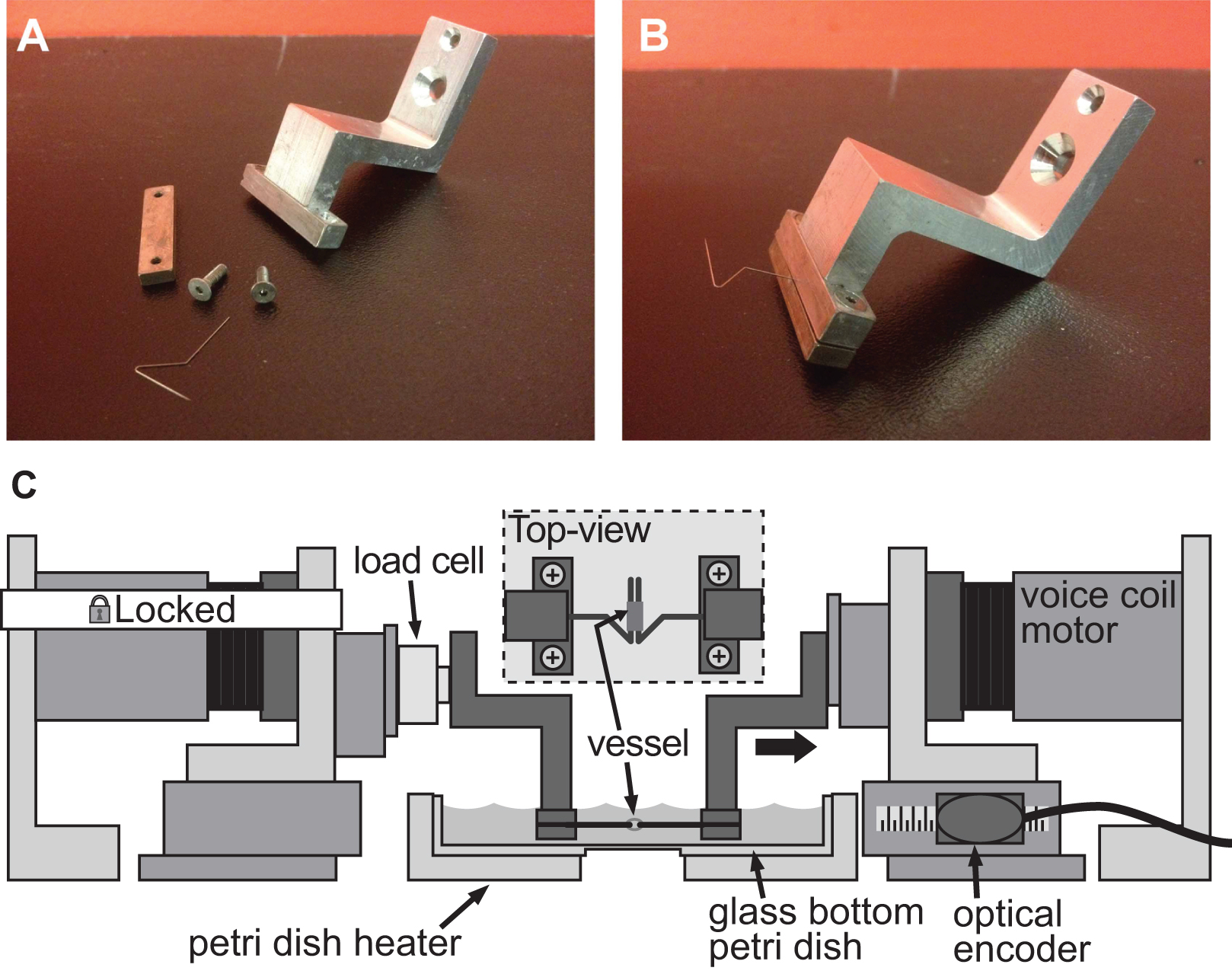
Figur 4. Expel på ett fastspänningssystem för styvhet bedömning av finkalibriga fartyg. AB) Detaljerade bilder av fastspänningssystem används för att inducera deformation i en 1 mm mus diameter aorta. Stift av rostfritt stål var noggrant formas till öppna trianglar för att tillåta fartyget att glida på båda stiften. C) Illustration av den BAXS plattform med klämmorna håller kärlet och en lastcell fäst mellan den fasta motorn och den vänstra klämman. Den infällda bilden visar en detaljerad vy ovanifrån av kärlet monterad på tapparna.
Protocol
Representative Results
Discussion
Den BAXS plattform presenteras här underlättar många experiment i studien av mechanobiology, från undersökningar av enskilda celler för att hela vävnader. Dessutom är plattformen mycket flexibel och konfigurerbar, vilket möjliggör ett stort antal mekanisk stimulering experiment och multiaxiell dragprovning. Plattformen möjliggör också upprätthållandet av celler och vävnader under fysiologiska betingelser och ger möjlighet till samtidig mikroskopi under stretching experiment. De två experiment som beskr…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
DT fick stöd av ett postdoktorsanställning från le Fonds de Recherche du Quebec-Nature et Technologies (FQRNT) och en MITACS Elevate strategisk Fellowship. CMC fick stöd av ett postdoktorsanställning från le Fonds de Recherche en Santé du Québec (FRSQ) och Ernest och Margaret Ford kardiologi begåvat forskning stipendium från University of Ottawa Hjärtainstitutet. EOB stöddes av verksamhetsbidrag MOP80204 från den kanadensiska Institute for Health Research (CIHR) och T6335 från hjärtat och Stroke Foundation i Ontario. Den CIHR och Medtronic tillsammans ger EOB med en peer-reviewed forskning ordförande (URC # 57093). AEP finansieras av naturvetenskaplig och teknisk forskning Council (NSERC) Discovery Grant, en NSERC Discovery Accelerator Supplement och tacksamt erkänner stöd från Kanada Research Chairs (CRC) program och en tidig forskare Award från provinsen Ontario.
Materials
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| optical encoder | GSI microE systems | Mercury II 1600S – 0.5um resolution | reflective incremental encoder. |
| motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0,20mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28V flexible heaters; can be supplied with a 24V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0,05% | Hyclone | SH30236,02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/ 5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
Riferimenti
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).

