הביולוגי קטליזה חמה: Isothermal טיטרציה Calorimetry לאפיין תגובות אנזימטיות
Summary
זרימת חום אמצעי calorimetry טיטרציה Isothermal שוחררה או נספגת בתגובות כימיות. בשיטה זו ניתן להשתמש כדי לכמת אנזים-קטליזה. במאמר זה, הפרוטוקול להתקנה אינסטרומנטלית, ניתוח ניסוי ריצה, ונתונים מתוארים בדרך כלל, ופנה לאפיון של הידרוליזה אוריאה האנזימטית של urease שעועית שקע.
Abstract
calorimetry טיטרציה Isothermal (ITC) הוא טכניקה שתוארה היטב שמודדת את החום שמשתחרר או נספג במהלך תגובה כימית, שימוש בו כבדיקה פנימית כדי לאפיין כמעט כל תהליך כימי. כיום, טכניקה זו מיושמת באופן נרחב כדי לקבוע פרמטרים תרמודינמיים של שיווי משקל מחייב biomolecular. בנוסף, ITC הודגם להיות מסוגל ישירות מדידת קינטיקה ופרמטרים תרמודינמיים (k חתול, K M, ΔH) של תגובות אנזימטיות, למרות שהיישום הזה הוא עדיין underexploited. כמו שינויים בחום באופן ספונטני להתרחש במהלך קטליזה האנזימטית, ITC אינו דורש כל שינוי או תיוג של המערכת תחת ניתוח וניתן לבצעו בתמיסה. יתר על כן, השיטה זקוקה לכמות קטנה של חומר. תכונות אלו הופכות את ITC כלי רב ערך, רב עוצמה והייחודית ללמוד קינטיקה אנזים במספר יישומים, כגון, למשל, גילוי תרופות.
<p cילדה = "jove_content"> בעבודה זו שיטה המבוססת על ITC ניסיוני לכמת קינטיקה ותרמודינאמיקה של תגובות אנזימטיות מתוארת ביסודיות. שיטה זו מיושמת על מנת לקבוע k חתול וK M של הידרוליזה אנזימטית של אוריאה על ידי ensiformis Canavalia urease (שעועית שקע). חישוב של אנתלפיה הפנימית טוחנת (int ΔH) של התגובה מתבצע. הערכים וכך השיגו עולים בקנה אחד עם נתונים קודמים שדווחו בספרות, הוכיחו את האמינות של המתודולוגיה.Introduction
קביעת כמותית של תגובות ביוכימיות מספקת תובנות לגבי התהליכים הביולוגיים העומדת בבסיס של חיים. Calorimetry מציע מתודולוגיה ללא תווית לאפיין כמעט בכל תגובה כימית בפתרון כמותית. טכניקה זו מודדת את החום שמשתחרר או נספג לאורך זמן, ולכן מערכת זיהוי אוניברסלית ומתודולוגיה נוחה מאוד לכמת את כמות המולקולות מגיבים (כלומר תרמודינמיקה מחייבת), כמו גם על מנת למדוד את קצב התגובה (כלומר קינטיקה). בפרט, calorimetry טיטרציה בידוד התרמי (ITC) כבר אימץ כשיטת בחירה לאפיין את התרמודינאמיקה של שיווי משקל biomolecular, הכולל חלבון ליגנד, חלבונים, יוני חלבון מתכת ואינטראקציות החלבון-DNA 1-6. בנוסף, היכולת של ITC לספק מידע הקינטית הופכת אותו למערכת חזקה מאוד למדוד קטליזה אנזים, למרות שהפוטנציאל של יישום זה הוא עדייןלזלזל 7-9.
משוואת מיכאליס מנטן-10 היא תיאור כמותי של תגובות אנזימטיות, כפי שהוא מספק קשר בין קצב התגובה וריכוז המצע, תלוי בשני פרמטרים הקינטית: קבוע מיכאליס (K M) ושיעור קבוע קטליטי (k חתול) . K החתול / יחס K M הוא כאמור את היעילות הקטליטית של אנזים. בפועל, קביעת K M ו-k חתול לתגובה ספציפית מספק תיאור של קטליזה מלאה.
בתגובה האנזימטית טיפוסית (איור 1), מצע (S) אינטראקציה עם האנזים (E) ויוצר מורכבות אנזים-מצע (ES), שמופעל בהמשך למצב המעבר (ES *). זה האחרון הופך למורכב אנזים תוצר הלוואי (EP) שסופו של הדבר dissociates. צעד הבאיםים מתוארים על ידי התגובה הבאה.
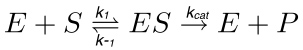 (1)
(1)
כאשר k 1 הוא השיעור קבוע להקמת קומפלקס ES, k -1 הוא שיעור קבוע לדיסוציאציה של קומפלקס ES, בעוד k החתול הוא שיעור קבוע קטליטי או מספר מחזור.
לפי משוואת מיכאליס מנטן-10, שיעור התגובה יכול להיות מחושב כ:
 (2)
(2)
שבו חתול K = M (k -1 + K חתול) / k 1 ו-k = מקסימום v / [E], עם מקסימום v להיות המהירות המקסימלי הגיעה כאשר כל האנזים קשור למצע.
Calorimeter טיטרציה הבידוד התרמית היא הכלי המשמש במחקר זה כדי לאפיין את הידרוליזה אנזימטית של אוריאה. מכשיר זה עשוי ממגן adiabatic המכיל שני תאים בצורת שטבע (איור 1). אלה מחוברים לחלק החיצוני עם צינורות גישה צרים. התא המדגם (בערך 1.4 מיליליטר) טעון עם פתרון האנזים, ואילו תא ההתייחסות הוא בדרך כלל מלא במים או בממסים המשמשים לניתוח. מזרק מסתובב עם מחט ארוכה והנעת מערבבים המצורפות, המכיל בדרך כלל CA. 0.3 מיליליטר של תמיסת מצע, הוא רכוב על התא המדגם. מכשיר תרמואלקטרי מודד את ההבדל בטמפרטורה בין המדגם ותא ההתייחסות ו, באמצעות "רשת משוב סלולרי", הוא שומר על ההבדל הזה באפס על ידי הוספה או הפחתת חום. במהלך הניסוי, המצע מוזרק לתוך תמיסת האנזים בטמפרטורה שנבחרה קבועה. כאשר enתגובת zymatic מתרחשת, כמות החום שמשתחררת או נספגת היא פרופורציונלית למספר מולקולות מצע, שהומרו למולקולות מוצר. בנוסף, שיעור זרימת חום קשור באופן ישיר לשיעור של התגובה. נתונים שנמדדו, המופיע כסטייה של עקבות חום מנקודת ההתחלה ראשונית (איור 1), מייצגים את כוח התרמיות (μcal / sec) המסופק על ידי המכשיר הסלולרי המדגם, שהוא פרופורציונאלי לזרימת החום המתרחשת בתא המדגם לאורך זמן.

איור 1. ייצוג סכמטי של calorimeter טיטרציה בידוד התרמית ללמוד תגובות אנזימטיות. תגובה האנזימטית מתרחשת על טיטרציה של המצע (במזרק להזרקה) לתוך תמיסת האנזים (בתא המדגם) גורם לשינוי של יסכוח mal שפורסם על ידי calorimeter, דרוש כדי לשמור על הפער של טמפרטורה בין תא דגימה וקבוע תא התייחסות. לחץ כאן לצפייה בתמונה גדולה יותר.
בסך הכל, השינוי בחום (Q) הוא פרופורציונאלי לאנתלפיה הטוחנות של התגובה (ΔH) ומספר השומות של מוצר שנוצר (n), אשר בתורו ניתן על ידי בסך הכל הפעמים נפח הריכוז:
 (3)
(3)
היווצרות המוצר לאורך זמן (DP / DT), אשר תואם את קצב התגובה, ולכן יכול להיות קשור לכמות החום שנוצר על אותו הזמן (DQ / dt) דרך היחס:
 (4)
(4)
על פי משוואה זו, על מנת לקבל מיכאליס-מנטן עלילה יש צורך למדוד i) סך ΔH אנתלפיה טוחנת, וii) את זרימת DQ / dt החום בריכוזים מצע שונים. בדרך כלל, זה מתבצע בשני ניסויים שונים: בניסוי הראשון (שיטת 1, M1), המצע מוזרק לתוך תמיסת האנזים והחום לגיור מצע שלם נמדד; בניסוי השני (השיטה 2, M2), זריקות מרובות של מצע מבוצעות וקצב ייצור חום נמדד בריכוזים מצע שונים. שתי מערכות אלו של נתונים מספיקות כדי לגזור את הפרמטרים הקינטית K M ו-k חתול.
במאמר הנוכחי, פרוטוקול כללי כדי לקבוע את הפרמטרים הקינטית לתגובות אנזימטיות בוצעו באמצעות ITC מתואר. אנחנו יישמנו את השיטה להידרוליזה אוריאה על ידי האוריאה ensiformis Canavaliase, כמערכת התייחסות. ההסכם הטוב בין התוצאות שהתקבלו בשיטה זו ונתונים שדווחו בספרות מדגים את האמינות של גישה זו.
Protocol
Representative Results
Discussion
משמעות של ITC ללמוד פעילות האנזימטית ביחס לשיטות קיימות
בנוסף ליישומים הקלאסיים שלה ללמוד שיווי משקל מחייב, calorimetry טיטרציה בידוד התרמי מספק שיטה מהירה ואמינה לאפיון תגובות אנזימטיות בפתרון באמצעות החום של תגובה כמו בדיק…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
התמחות מוצרי חברת דשנים (SFP) הוא הודה למתן את הכספים הדרושים למחקר זה.
Materials
| HEPES | Sigma | H3375 | dissolving in water and adjusting pH with NaOH |
| TRIZMA-Base | Sigma | T1503 | dissolving in water and adjusting pH with HCl |
| Sodium dihydrogen phosphate | Riedel-de-Haen | 4270 | dissolving in water |
| Sodium phosphate dibasic | Riedel-de-Haen | 30427 | dissolving in water |
| Urea | Sigma | U4128 | dissolving in water at 40 °C |
| Canavalia ensiformis urease (type C-3) | Sigma | U0251 | dissolving in 20 mM HEPES pH 7 and stored at -80 °C |
| VP-ITC on Origin 7.0 | MicroCal (GE Healthcare) | SYS13901 | instrument |
| VPViewer2000 1.30.00 on Origin 7.0 | MicroCal (GE Healthcare) | data acquisition software supplied with the instrument |
Riferimenti
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr. Opin. Struct. Biol. 11, 560-566 (2001).
- Ladbury, J. E. Application of isothermal titration calorimetry in the biological sciences: things are heating up! BioTechniques. 37, 885-887 (2004).
- Zambelli, B., Bellucci, M., Danielli, A., Scarlato, V., Ciurli, S. The Ni2+ binding properties of Helicobacter pylori NikR. Chem. Commun. , 3649-3651 (2007).
- Zambelli, B., et al. High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J. Mol. Biol. 383, 1129-1143 (2008).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J. Vis. Exp. , (2011).
- Ghai, R., Falconer, R. J., Collins, B. M. Applications of isothermal titration calorimetry in pure and applied research–survey of the literature from 2010. J. Mol. Recognit. 25, 32-52 (2012).
- Todd, M. J., Gomez, J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity. Anal. Biochem. 296, 179-187 (2001).
- Bianconi, M. L. Calorimetry of enzyme-catalyzed reactions. Biophys. Chem. 126, 59-64 (2007).
- Demarse, N. A., Killian, M. C., Hansen, L. D., Quinn, C. F. Determining enzyme kinetics via isothermal titration calorimetry. Methods Mol. Biol. 978, 21-30 (2013).
- Michaelis, L., Menten, M. Die kinetik der invertinwirkung. Biochem. Z. 49, 333-369 (1913).
- Walker, J., Wilson, K., Walker, J. . Principle and techniques of practical biochemistry. , 312-356 (2000).
- Ciurli, S., Sigel, A., Sigel, H., Sigel, R. K. O. . Nickel and its surprising impact in nature. 2, 241-278 (2007).
- Zambelli, B., Musiani, F., Benini, S., Ciurli, S. Chemistry of Ni2+ in urease: sensing, trafficking, and catalysis. Acc. Chem. Res. 44, 520-530 (2011).
- Zonia, L. E., Stebbins, N. E., Polacco, J. C. Essential role of urease in germination of nitrogen-limited Arabidopsis thaliana seeds. Plant Physiol. 107, 1097-1103 (1995).
- Follmer, C. Insights into the role and structure of plant ureases. Phytochemistry. 69, 18-28 (2008).
- Sumner, J. B. The isolation and crystallization of the enzyme urease. J. Biol. Chem. 69, 435-441 (1926).
- Krajewska, B. Ureases I. Functional, catalytic and kinetic properties: A review. J. Mol. Cat. B. 59, 9-21 (2009).
- Callahan, B. P., Yuan, Y., Wolfenden, R. The burden borne by urease. J. Am. Chem. Soc. 127, 10828-10829 (2005).
- Krajewska, B., van Eldik, R., Brindell, M. Temperature- and pressure-dependent stopped-flow kinetic studies of jack bean urease. Implications for the catalytic mechanism. J. Biol. Inorg. Chem. 17, 1123-1134 (2012).
- Hausinger, R. P., Karplus, P. A., Huber, R., Poulos, T., Wieghardt, K. . Handbook of Metalloproteins. , 867-879 (2001).
- Goldberg, R., Kishore, N., Lennen, R. Thermodynamic quantities for the ionization reactions of buffers. J. Phys. Chem. Ref. Data. 31, 231-370 (2002).
- Baumann, M. J., et al. Advantages of isothermal titration calorimetry for xylanase kinetics in comparison to chemical-reducing-end assays. Anal. Biochem. 410, 19-26 (2011).
- Noske, R., Cornelius, F., Clarke, R. J. Investigation of the enzymatic activity of the Na+,K+-ATPase via isothermal titration microcalorimetry. Biochim. Biophys. Acta. 1797, 1540-1545 (2010).
- Harmon, K. M., Niemann, C. The competitive inhibition of the urease-catalyzed hydrolysis of urea by phosphate. J. Biol. Chem. 177, 601-605 (1949).
- Benini, S., Rypniewski, W. R., Wilson, K. S., Ciurli, S., Mangani, S. Structure-based rationalization of urease inhibition by phosphate: novel insights into the enzyme mechanism. J. Biol. Inorg. Chem. 6, 778-790 (2001).
- Segel, I. H. . Enzyme kinetics: behavior and analysis of rapid equilibrium and steady-state enzyme systems. , (1993).

