Imaging di fluorescenza con One nanometri Precisione (FIONA)
Summary
Fluorofori singoli possono essere localizzati con precisione nanometrica utilizzando FIONA. Ecco un riassunto della tecnica FIONA è segnalato, e come condurre esperimenti Fiona è descritto.
Abstract
Fluorescenza per immagini con una precisione di un nanometro (FIONA) è una tecnica semplice ma utile per la localizzazione di singoli fluorofori con precisione nanometrica nel piano xy. Ecco un riassunto della tecnica FIONA è segnalato ed esempi di ricerche che sono state eseguite utilizzando FIONA vengono brevemente descritti. In primo luogo, come impostare le attrezzature necessarie per gli esperimenti FIONA, vale a dire, per un totale interno microscopia a fluorescenza di riflessione (TIRFM), con dettagli sulle allineare le ottiche, è descritto. Poi come realizzare un esperimento semplice FIONA sulla localizzazione immobilizzato Cy3-DNA singole molecole utilizzando protocolli appropriati, seguita dall'uso di FIONA per misurare la dimensione del passo 36 nm di un singolo miosina troncato motore Va marcato con un punto quantico, è illustrato. Infine, è segnalato recente sforzo di estendere l'applicazione di FIONA a campioni di spessore. Si dimostra che, utilizzando un obiettivo immersione in acqua e punti quantici imbevuto nel profondo sol-gel e cornee degli occhi di coniglio (>200 micron), la localizzazione di precisione di 2-3 nm può essere raggiunto.
Introduction
Intorno al 1882, Ernst Abbe rilevato che la risoluzione di un microscopio a luce visibile è ~ λ / 2NA, o ~ 200 nm (dove λ è la lunghezza d'onda e NA è l'apertura numerica) 1,2. Pertanto, qualsiasi oggetto più piccolo di questa dimensione potrebbe apparire come una macchia di diffrazione limitata in un microscopio ottico. Tuttavia, è possibile determinare il centro della macchia, che è, la posizione dell'oggetto, con una precisione molto maggiore 3. Fluorescenza per immagini con una precisione di un nanometro (FIONA) è una tecnica semplice ma utile per la localizzazione di singoli fluorofori con precisione nanometrica nel piano xy 4. La precisione di localizzazione, σ μ (cioè, l'errore standard della media), dipende dal numero totale di fotoni raccolti, 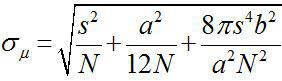 , Dove N è il conteggio di fotoni, s è la deviazione standard della macchia fluorescente, una èla dimensione in pixel del rivelatore di immagine, e b è la deviazione standard del fondo 3,4. Per un fluoroforo che emette ~ 10.000 fotoni, FIONA può raggiungere ~ 1 nm precisione 4.
, Dove N è il conteggio di fotoni, s è la deviazione standard della macchia fluorescente, una èla dimensione in pixel del rivelatore di immagine, e b è la deviazione standard del fondo 3,4. Per un fluoroforo che emette ~ 10.000 fotoni, FIONA può raggiungere ~ 1 nm precisione 4.
FIONA può essere utilizzato per determinare con precisione la posizione di un emettitore stazionaria, o uno spostamento (supponendo immagini possono essere adottate abbastanza veloce). FIONA può essere applicato in modo sequenziale ai fotogrammi del film e quindi tiene il moto della singola molecola 4-8. Reagenti foto-protezione possono essere necessarie per garantire che il campione non fotodegradare. Inoltre, l'oggetto fluorescente stesso può essere di qualsiasi dimensione, più piccola o più grande della diffrazione LIMIT- ad esempio, essa può consistere di un organello (~ 1 micron), con molte proteine fluorescenti dispersi sulla sua membrana. Utilizzando FIONA può ancora produrre un molto accurata (nanometri) media del centro-di-massa media. Il grande miglioramento nella precisione della localizzazione di Fiona permette risolvendo nanomemovimenti di ter-scala nel corso del tempo. Questo ha spinto la microscopia in scala di lunghezza molecolare 4-8.
Fin dalla sua invenzione, sono state sviluppate varianti di FIONA. Ad esempio, l'imaging in campo chiaro con una precisione di un nanometro (bFIONA) 9, una leggera variante di FIONA, immagini e localizza gli oggetti densi come melanosomi vivo (oggetti scuri che contengono il pigmento melanina) con luce trasmessa. Inoltre, FIONA è stato impiegato per risolvere diversi coloranti. Ad esempio, singola molecola imaging ad alta risoluzione con photobleaching (gamberetti) 10,11 o ad alta risoluzione di una singola molecola co-localizzazione (SHREC) 12 sono stati sviluppati per risolvere due coloranti all'interno di circa 10 nm. (Si noti che questa è la risoluzione, vale a dire con precisione come si può dire coloranti identici a parte.) Più recentemente, l'analisi FIONA ha contribuito al processo di localizzazione di alcuni microscopia a super-risoluzione, come reco ottica stocasticamicroscopia nstruction (STORM) 13- 15 e la foto-attivato localizzazione microscopio (PALM) 16, in cui fluorofori scure temporanee sono entusiasti, e poi la fluorescenza è localizzata. Con ripetutamente eccitante piuttosto bassa densità di coloranti (meno di uno per diffrazione macchia limitata), e poi raccogliendo la fluorescenza, analizzando ciascuno di loro dalla FIONA, si può costruire una mappa ad alta risoluzione. La risoluzione è quindi solo limitata dal numero di fotoni ciascun colorante mette fuori, così come le cose come tenere fermo il campione (compresi, per esempio, la fase di microscopio) durante l'acquisizione.
In questo lavoro, una sintesi della tecnica FIONA e brevemente descrivono esempi di ricerche che sono state eseguite utilizzando FIONA viene segnalato. In primo luogo, come impostare le attrezzature necessarie per gli esperimenti FIONA, vale a dire, per un totale interno microscopia a fluorescenza di riflessione (TIRFM), con dettagli sulle allineare le ottiche, è descritto. Poi comeeffettuare un esperimento semplice FIONA sulla localizzazione immobilizzato Cy3-DNA singole molecole utilizzando opportuni protocolli, è illustrato. Dopo di che, l'uso di FIONA per misurare la dimensione del passo 36 nm di un singolo miosina troncato motore Va marcato con un punto quantico è presentato. Miosina Va è una proteina motore processivo essenziale che trasporta merci cellulare mentre translocating lungo i filamenti di actina. Ecco un miosina Va costruire troncato viene utilizzato per rimuovere i domini irrilevanti per la dimensione del passo, e con un tag FLAG aggiunto al C-terminale per consentire facilità di etichettatura con punti quantici funzionalizzati con anticorpi anti-FLAG. Questo esperimento viene fatto in condizioni di scarsa ATP per rallentare la miosina e consentire l'uso di tempi di esposizione abbastanza a lungo per ottenere un buon numero di fotoni in ogni fotogramma. Qualsiasi etichetta fluorescente sufficientemente luminosa potrebbe essere sostituito nel seguente protocollo. Infine, viene riportato recente sforzo di estendere l'applicazione di FIONA a campioni di spessore. Come principio proof-of-, punti quantici sono stati inzuppatiin sol-gel e cornee degli occhi coniglio e poi ripreso e localizzata utilizzando FIONA. Per l'imaging, un obiettivo ad immersione 60X acqua con NA = 1.2 è stato utilizzato perché questo obiettivo ha una distanza di lavoro più lungo utilizzato in precedenza 100X obiettivo immersione in olio. Per compensare la perdita di ingrandimento dell'obiettivo, una lente extra-ingrandimento (3.3X o 4.0X) è stato inserito nel percorso di emissione. Inoltre, epi-fluorescenza (non TIR) microscopia deve essere utilizzato per accedere regioni profonde nei campioni spessi. E 'dimostrato che i punti quantici imbevuti nel profondo sol-gel e in cornee degli occhi di coniglio (Z> 200 micron) possono essere localizzati con precisione di 2-3 nm.
Protocol
Representative Results
Discussion
Fiona è una tecnica per localizzare la posizione di un emettitore fluorescente (fluoroforo organico o quantum dot) con una precisione nanometrica e risoluzione temporale fino a 1 msec a 4 8. Quando abbastanza fotoni vengono raccolti, questa tecnica consente di determinare la posizione di un emettitore fluorescente molto più preciso rispetto al limite di diffrazione (~ 200 nm) e quindi questa tecnica apre un modo per osservare ciò non è stato visto con microscopia ottica convenzionale / tradizionale 4…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato sostenuto da NIH Grants 068.625, sovvenzioni NSF 1.063.188 e Centro di Fisica di cellule viventi 0822613. Un ringraziamento particolare va al Dr. Marina Marjanovic in Beckman Institute for Advanced Science and Technology per il dono di occhi di coniglio.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Riferimenti
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

