Luminescentie Resonance Energy Transfer om te studeren vormveranderingen in membraaneiwitten Uitgedrukt in zoogdiercellen
Summary
We beschrijven hier een verbeterde werkwijze Luminescentie Resonance Energy Transfer (LRET) waarin we introduceren protease splitsingsplaats tussen de donor en acceptor fluorofoor sites. Deze modificatie kunnen wij specifieke LRET signalen die door membraaneiwitten plaats, waardoor de studie van membraaneiwitten zonder eiwitzuivering verkrijgen.
Abstract
Luminescentie Resonance Energy Transfer, of LRET, is een krachtige techniek die wordt gebruikt om afstanden tussen twee locaties in eiwitten binnen de afstand bereik van 10-100 een maatregel. Door het meten van de afstanden onder verschillende omstandigheden geligeerd kunnen conformatieveranderingen van het eiwit gemakkelijk worden bepaald. Met LRET, een lanthanide, meestal chelaat terbium wordt gebruikt als de donor fluorofoor, bieden voordelen zoals een langere only donor emissie levensduur, de flexibiliteit om meerdere acceptor fluoroforen gebruikt, en de mogelijkheid voor overgevoelige acceptor emissie detecteren als een makkelijke manier om energieoverdracht zonder het risico ook detecteren alleen donor-signaal te meten. Hier beschrijven we een werkwijze te gebruiken op LRET membraaneiwitten expressie gebracht en getest op het oppervlak van intacte zoogdiercellen. We introduceren een proteasesplitsingsplaats tussen de LRET fluorofoor paar. Na het verkrijgen van het oorspronkelijke signaal LRET splitsing op die plaats verwijdert het specifieke LRET signaal van het eiwit vanbelang waardoor we kwantitatief aftrekken van de achtergrond signaal dat overblijft na splitsing. Deze methode zorgt voor meer fysiologisch relevante metingen kunnen worden uitgevoerd zonder de noodzaak voor zuivering van eiwitten.
Introduction
Luminescentie Resonance Energy Transfer (LRET) is een afgeleide van de bekende Fluorescence Resonance Energy Transfer (FRET) techniek 1. Vergelijkbaar met FRET kan LRET worden gebruikt om afstanden en veranderingen afstand tussen donor en acceptor fluoroforen aan specifieke plaatsen op het eiwit van belang in het traject van 10-100 A 1-3 meten. De principes van LRET zijn ook gelijkwaardig aan FRET doordat resonantie energieoverdracht plaatsvindt tussen twee proximale fluoroforen wanneer het emissiespectrum van de donor fluorofoor overlapt met het absorptiespectrum van de acceptor fluorofoor. De efficiëntie van deze overdracht is gerelateerd aan de afstand tussen de twee fluoroforen door de volgende vergelijking:
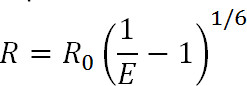 Eq. 1
Eq. 1
waarbij R de afstand tussen de twee fluoroforen, E het rendement van engie-overdracht, en R 0, hieronder besproken, is de Förster straal voor de fluorofoor paar, dat wil zeggen de afstand waarop de efficiëntie van de overdracht is halfmaximale. Uit deze vergelijking kan men zien dat de efficiëntie is gerelateerd aan de grootte van de afstand verhoogd tot de inverse zesde macht 1. Hierdoor omgekeerde zesde macht afhankelijkheid waardoor FRET en LRET metingen uiterst gevoelig, zelfs voor kleine veranderingen afstand wanneer bij R 0 van het FRET paar. Het vermogen specifiek label gewenste plaatsen op eiwitten of andere macromoleculen kan men profiteren van deze gevoeligheid voor conformationele veranderingen volgen.
Vergeleken met FRET, die gebruikelijk organische kleurstofmoleculen gebruikt, LRET biedt extra voordelen. In LRET, in plaats van een organische kleurstof als de donor fluorofoor, een lanthanide serie kation typisch Tb 3 + of Eu3 + wordt gebruikt 1,4-6. Fluoroforen dat u vallennder categorie, bijvoorbeeld terbium chelaat, zijn ook zeer veelzijdig omdat ze kunnen worden gebruikt met een uitgebreide lijst van acceptor fluoroforen. Deze flexibiliteit is mogelijk omdat de emissiespectra van chelaten lanthaniden meerdere scherpe emissiepieken bevatten, waardoor een enkele soort donor fluorofoor te gebruiken met een van een groot aantal acceptor fluoroforen. Zo kan gesensibiliseerd acceptor emissie worden waargenomen, zonder enige vrees voor besmetting door-bloeding van donor emissie 5. De experimentator selecteert de specifieke acceptor gebaseerd op de verwachte afstand tussen de twee fluoroforen (Figuur 1 en Tabel 1). In deze lanthanide chelaat fluoroforen, is het metaalion gechelateerd door een molecuul dat een antenne groep die de normaal slecht absorberende lanthanide sensibiliseert zo goed excitatie een bioreactieve functionele groep om het ion tether een specifieke functionele groep op de 1 macromolecuul bevat, 5,6. Once opgewonden, lanthaniden ontspannen naar de grondtoestand door het vrijgeven van fotonen met een vervalsnelheid in milliseconden. Omdat het verval is noch een singlet-to-singlet ontspanning noch een triplet-to-singlet ontspanning, de emissie van fotonen kunnen niet goed worden fluorescentie of fosforescentie genoemd, maar is meer goed genoemd luminescentie 1. De lange verval van lanthanide luminescentie helpt enorm in leven metingen. Lifetime metingen kunnen vervolgens worden gebruikt om de efficiëntie via de volgende relatie te bepalen:
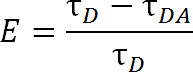 Eq. 2
Eq. 2
waar, E is de efficiëntie van de overdracht, τ D is de levensduur van de donor (gecheleerde lanthanide) wanneer die niet deelnemen aan de energie-overdracht, en τ DA is de levensduur van de donor bij deelname aan de energie-overdracht met de acceptor. Met LRET, τ DA kan aldus worden gemeten als de levensduur van de gevoelige acceptor emissie omdat de levensduur terbium is zo veel groter dan een organische acceptorfluorofoor. De acceptor stoot met dezelfde levensduur als de aanzetten tot excitatie (donor lanthanide), en de eventuele bijdrage aan de levensduur van de acceptant eigen intrinsieke fluorescentie levensduur is relatief verwaarloosbaar. Door meting van de gesensibiliseerde emissie plaats donor emissie ook overbodig etikettering zorgen precies een 1: 1 verhouding van donor acceptor. Eiwitten kunnen in plaats daarvan gelijktijdig worden gemerkt met zowel acceptor en donor fluoroforen. Een heterogeen label bevolking zal leiden, maar dubbel-donor gelabelde eiwitten zal niet uitzenden in de acceptor golflengte en double-acceptor gelabelde eiwitten zullen niet enthousiast zijn. Bovendien dient de afstand tussen fluoroforen hetzelfde zijn, ongeacht welke cysteïne ter een gegeven fluorofoor hecht aan, vooral bij gebruik van de isotrope lanthaniden als donor, zodat de need naar een bepaalde site om ofwel de donor of acceptor is onnodig te specificeren. Intensiteit kan worden beïnvloed met een heterogene populatie, maar moet nog steeds ruim voldoende detecteerbaar zijn.
Bij het plannen experimenten, moet de keuze van fluoroforen worden gedicteerd door de R 0 waarde van het paar en het verwachte bereik afstand wordt gemeten. De R waarde 0 wordt gedefinieerd door de volgende vergelijking:
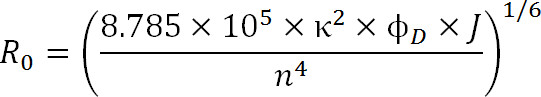 Eq. 3
Eq. 3
wanneer R 0 het Förster radius in Angstrom, κ 2 de oriëntatie factor tussen de twee kleurstoffen (gewoonlijk aangenomen dat 2/3), φ D is de quantumopbrengst van de donor, J de spectrale overlap integraal tussen de donor emissiespectrum en de acceptant absorptie spectrum in M – 1cm -1 nm 4, en n de brekingsindex van het medium 1.
Ons laboratorium heeft een wijziging van de gebruikelijke techniek LRET toegevoegd door invoeging van een protease herkenningsplaats tussen de donor en acceptor label plaatsen op het eiwit wordt gesondeerd. Deze modificatie maakt onderzoek niet gezuiverde systemen als geheel zoogdiercellen 7. Deze techniek is bijzonder nuttig bij het gebruik cysteïnen als gebieden te kenmerken, aangezien het proces van labeling met maleïmide geconjugeerd kleurstoffen die binden aan cysteine sulfhydryl groepen, andere eiwitten op de cellen die moeten cysteïnen zijn ook gelabeld. Echter, door op protease splitsingsplaatsen op het eiwit van interesse en meten levensduur voor en na splitsing, de experimentator kan kwantitatief aftrekken van de achtergrond signaal nadat protease klieving van het grove signaal. Dit aftrekken isoleert het signaal gevolg van het eiwit van belang (Figure 2). Met de hierboven beschreven modificatie kan LRET worden om veranderingen afstand tussen de terbium chelaat donor en acceptor probe een eiwit meten toe te zien conformationele veranderingen in het eiwit dichtbij fysiologische toestand zonder de noodzaak voor zuivering.
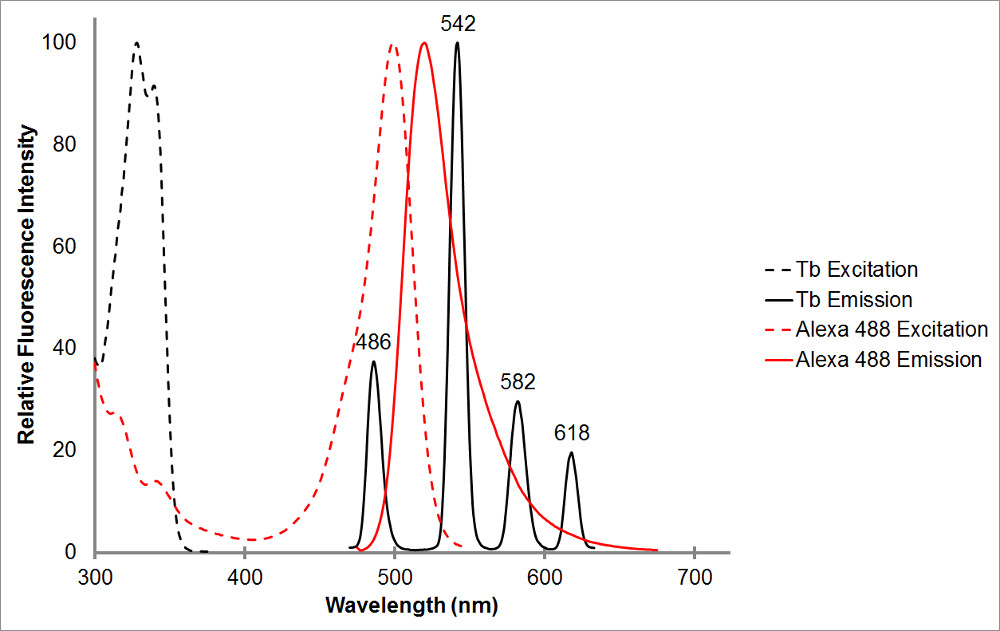
Figuur 1.Het absorptie en emissie spectra van gecheleerd terbium in zwart, en een vertegenwoordiger acceptor, Alexa 488, in rood. Merk de meervoudige emissiepieken en scherpe, smalle emissiebereik voor elke piek van terbium chelaat. Dit patroon maakt terbium te gebruiken met verschillende acceptor fluoroforen en vergemakkelijkt de meting van gesensibiliseerde emissie binnen deze trajecten waar terbium vertoont geen emissie. Terbium's emissie piek bij 486 nm overlapt heel goed met de een bsorption piek van Alexa 488, waardoor resonantie energieoverdracht plaatsvindt tussen de twee fluoroforen. Een golflengte van 515 nm is een uitstekende keuze om gesensibiliseerd uitstoot te detecteren voor dit pair zoals het is in het dal tussen de terbium uitstoot pieken, en heel dicht Alexa 488's emissie piek van 520 nm. Let op dat in de buurt van de acceptor piek, hoewel wenselijk, niet noodzakelijk 565 nm nog kan Alexa 488 emissie detecteren, zonder ook het detecteren terbium emissie.
| Acceptorfluorofoor | R 0 (a) | Emissie golflengte (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluoresceïne | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tabel 1: Een overzicht van de meest gebruikte acceptorfluoroforen voor LRET gebruik terbium chelaat als de donor 11. De R 0-waarden werden gemeten wanneer de donor en acceptor werd aan de oplosbare agonist bindend domein van AMPA receptoren. Het is ideaal om de R 0 waarde opnieuw te meten voor elke nieuwe systeem wordt bestudeerd.
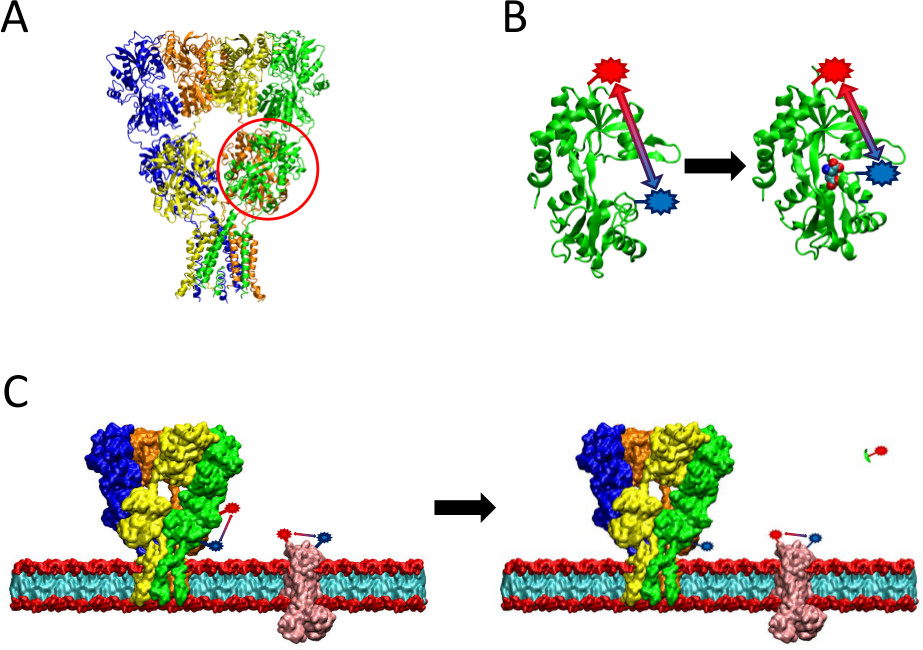
Figuur 2 een overzicht van de LRET methode gepresenteerd. (A) De AMPA receptor is een membraaneiwit dat conformationele veranderingen na ligandbinding ondergaat. De clamshell-vormige ligand-binding domein is hier rood omcirkeld. (B) Het ligandbindende gebied van AMPA wanneer niet gebonden aan eiwitten bekend in een open conformatie (links). Wanneer gebonden aan glutamaat ligand, het eiwit sluit rond de ligand (rechts). Door fluoroforen bewijskracht te plaatsen op het LBD, kan de aard van deze conformationele verandering gezien als de afstand tussen de fluoroforen veranderingen, die vervolgens invloed fluorescentie levensduur. (C) Etiketten gehele cellen, labeling van zowel het eiwit van belang en achtergrond membraaneiwitten kan (links) optreden. Na protease splitsing, zal LRET signaal van het eiwit van interesse verdwijnen door het vrijkomen van een oplosbaar fragment, waardoor achtergrondsignaal intact (rechts). Dit achtergrondsignaal kan vervolgens worden afgetrokken van het grove signaal.
Protocol
Representative Results
Discussion
LRET is een techniek waarmee wetenschappers om afstanden te meten tussen domeinen in een enkel eiwit en tussen subeenheden in een multimeer eiwit. Als zodanig is LRET goed geschikt voor onderzoek van de conformationele veranderingen en dynamiek van eiwitten of andere macromoleculen. Het bovenstaande protocol moet het goed uitgerust lab veranderd kunnen testen hun hypotheses; Er zijn echter veel voorkomende foutenbronnen dat de nieuwe onderzoeker kan teisteren. Indien weinig of geen LRET signaal wordt gezien, controleer …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door de National Institutes of Health Grant GM094246, de American Heart Association Grant 11GRNT7890004, en de National Science Foundation Grant MCB-1110501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Riferimenti
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochimica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

