הארה תהודת אנרגיה העבר לחקר שינויי קונפורמציה בחלבונים בממברנה שבאו לידי ביטוי בתאי יונקים
Summary
אנו מתארים כאן שיטת ההעברה השתפרה הארת תהודת אנרגיה (LRET) שבו אנחנו מציגים את אתר מחשוף פרוטאז בין אתרי fluorophore תורם acceptor. שינוי זה מאפשר לנו להשיג אותות LRET ספציפיים הנובעים מחלבונים קרום של עניין, המאפשרים המחקר של חלבונים בממברנה ללא טיהור חלבון.
Abstract
העברת הארה תהודת אנרגיה, או LRET, היא טכניקה רבת עוצמה המשמשת למדידת מרחקים בין שני אתרים בחלבונים בטווח המרחק של 10-100 א. על ידי מדידת המרחקים בתנאי ligated שונים, שינויי קונפורמציה של החלבונים ניתן להעריך בקלות. עם LRET, lanthanide, terbium לרוב chelated, משמש כfluorophore התורם, מעניק יתרונות כגון חיים ארוכים יותר תורמות בלבד פליטה, את הגמישות להשתמש fluorophores acceptor מרובה, ואת ההזדמנות כדי לזהות פליטת acceptor רגיש כדרך קלה כדי למדוד העברת אנרגיה ללא הסיכון של גם איתור אות תורם בלבד. כאן, אנו מתארים שיטה לשימוש LRET על חלבוני קרום הביע וassayed על פני השטח של תאי יונקים ללא פגע. אנחנו מציגים את אתר מחשוף פרוטאז בין זוג fluorophore LRET. לאחר קבלת אות LRET המקורית, מחשוף באתר זה מסיר את אות LRET הספציפי מהחלבון שלעניין ומאפשר לנו להפחית את אות הרקע שנשארה לאחר מחשוף כמותית. שיטה זו מאפשרת ליותר מבחינה פיזיולוגית מדידות רלוונטיות להתבצע ללא הצורך בטיהור של חלבון.
Introduction
העברת הארה תהודת אנרגיה (LRET) היא נגזרת של טכניקת העברה ידועה פלואורסצנטי תהודת אנרגיה (סריג) 1. בדומה לסריג, LRET ניתן להשתמש כדי למדוד מרחקים ושינויי מרחק בין fluorophores תורם acceptor המצורף לאתרים ספציפיים על החלבון של עניין בטווח של 10-100 Å 1-3. העקרונות של LRET דומים גם הם לסריג שבהעברת אנרגיית התהודה מתרחש בין שני fluorophores הפרוקסימלי כאשר ספקטרום הפליטה של fluorophore התורם חופף עם ספקטרום הספיגה של fluorophore acceptor. היעילות של העברה זו קשורה למרחק בין שני fluorophores על ידי המשוואה הבאה:
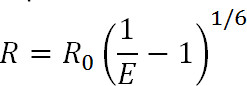 משוואה. 1
משוואה. 1
כאשר R הוא המרחק בין שני fluorophores, E הוא את היעילות של enהעברת ergy, וR 0, שיידון להלן, הוא רדיוס פורסטר לזוג fluorophore, כלומר המרחק שבו יעילות של העברה היא חצי מקסימאלי. ממשוואה זו, ניתן לראות את היעילות הקשור לסדר הגודל של המרחק בחזקה השישית ההפוכה 1. זה תלות זו הפוכה שישי כוח המאפשרת לסריג ומדידות LRET להיות רגישים להפליא אפילו לשינויי מרחק קטנים כאשר ליד R 0 של זוג סריג. היכולת לתייג באופן ספציפי אתרים הרצויים בחלבונים או מקרומולקולות אחרות מאפשרת לאדם לנצל את רגישות זו כדי לעקוב אחר שינויי קונפורמציה.
בהשוואה לסריג, אשר עושה שימוש במולקולות צבען אורגניים קונבנציונליות, LRET מציע יתרונות נוספים. בLRET, במקום להשתמש בצבע אורגני כfluorophore התורם, קטיון סדרת lanthanide, בדרך כלל Tb 3 + או האיחוד האירופי 3 +, משמש 1,4-6. Fluorophores שנופל under קטגוריה זו, למשל, chelate terbium, הם גם מאוד תכליתיים בכך שהם יכולים להיות בשימוש עם מגוון רחב של fluorophores acceptor. גמישות זו מתאפשרת בגלל ספקטרום הפליטה של lanthanides chelated להכיל פסגות פליטה חדות מרובות, המאפשר למין יחיד של fluorophore תורם לשימוש עם אחד ממגוון רחב של fluorophores acceptor. לפיכך, פליטת acceptor רגישה יכולה להיות מזוהה ללא כל חשש של זיהום לדמם דרך מפליטת תורם 5. הנסיין בוחר את acceptor הספציפי המבוסס על המרחק הצפוי בין שני fluorophores (איור 1 ולוח 1). בfluorophores lanthanide chelated אלה, יון מתכת chelated על ידי מולקולה המכילה קבוצת אנטנה שממגרת את lanthanide בדרך כלל גרוע, סופג לעירור, כמו גם קבוצה פונקציונלית bioreactive לקשור יון לקבוצה פונקציונלית ספציפית על מקרומולקולה 1, 5,6. Oncדואר נרגש, lanthanides להירגע למדינת הקרקע באמצעות שחרורו של פוטונים עם קצב דעיכה בטווח אלפית השנייה. בגלל הריקבון אינו הרפיה גופייה לגופייה ולא הרפיה שלישייה לגופייה, הפליטה של פוטונים לא יכולה כראוי להיקרא הקרינה או זרחני, אבל הוא יותר מכונה הארה 1 כראוי. הדעיכה של הארה lanthanide הארוכה מאוד עוזרת במדידות לכל החיים. מדידות חיים לאחר מכן ניתן להשתמש כדי לקבוע את יעילות באמצעות הקשר הבא:
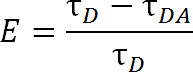 משוואה. 2
משוואה. 2
שם, E היא את היעילות של העברה, τ D הוא את חייו של התורם (lanthanide chelated) כאשר אינם משתתף בהעברת אנרגיה, וτ DA הוא את חייו של התורם בעת ההשתתפות בהעברת אנרגיה עם acceptor. עם LRET, DA τ יכול אלכך יימדד כחייו של פליטת acceptor רגיש משום שחייו של terbium הוא כל כך הרבה יותר גדול מfluorophore acceptor אורגני. Acceptor פולט עם אותו החיים כעירור (lanthanide התורם) ההסתה שלה, וכל תרומה לכל החיים מחי הקרינה הפנימית של acceptor עצמו היא יחסית זניחה. על ידי מדידת הפליטה רגישה ולא פליטת תורם, אנחנו גם מבטלים את הצורך להבטיח תיוג ב1 בדיוק: 1 יחס של תורם לacceptor. חלבון במקום יכול להיות מתויג בו זמנית עם שני acceptor וfluorophores תורם. אוכלוסיית שכותרת הטרוגני תגרום, אבל חלבוני שכותרתו כפול של תורם לא פולטים באורך גל acceptor וחלבוני שכותרתו הכפול acceptor לא יהיו נרגשים. יתר על כן, המרחק בין fluorophores צריך להיות זהה, ללא קשר לציסטאין אתר fluorophore ניתנו מתחבר ל, במיוחד בעת השימוש בlanthanides איזוטרופיים כתורם, כך לביתד כדי לציין אתר נתון לקבל גם התורם או acceptor הוא מיותר. עוצמת עשויה להיות מושפעת עם אוכלוסייה הטרוגנית, אבל עדיין צריכה להיות יותר מהדרוש כדי להתגלות.
בעת תכנון ניסויים, הבחירה של fluorophores צריכה להיות מוכתבת על ידי ערך R 0 של הזוג, כמו גם את טווח המרחק הצפוי נמדדים. ערך R 0 מוגדר על ידי המשוואה הבאה:
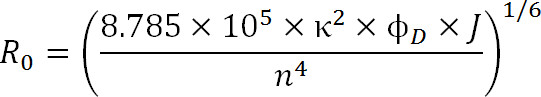 משוואה. 3
משוואה. 3
שבו, R 0 הוא הרדיוס פורסטר באנגסטרם, κ 2 הוא גורם האורינטציה בין שני הצבעים (בדרך כלל ההנחה היא להיות 2/3), φ D הוא התשואה הקוונטי של התורם, J היא החפיפה ספקטרלית נפרד בין התורם של ספקטרום פליטה וספקטרום הספיגה של acceptor בM – 1-1 סנטימטר 4 ננומטר, וn הוא מקדמת השבירה של המדיום 1.
המעבדה שלנו הוסיפה שינוי לטכניקת LRET הקונבנציונלית על ידי החדרת אתר הכרת פרוטאז בין אתרי תווית תורם ונוטל על החלבון שנחקר. שינוי זה מאפשר לחקירה במערכות מטוהרת שאינן כגון תאי יונקים כל 7. טכניקה זו שימושית במיוחד בעת שימוש בcysteines כאתרים לתיוג, שכן בתהליך של תיוג עם צבעי maleimide מצומדות- אשר נקלטים על ידי קבוצות sulfhydryl ציסטאין, חלבונים אחרים בתאים שיש לי cysteines גם מסומנים. עם זאת, על ידי הכללת אתרי מחשוף פרוטאז על החלבון של עניין ומדידת תקופות חיים לפני ואחרי המחשוף, הנסיין יכול כמותית להחסיר אות הרקע לאחר מחשוף פרוטאז מאות הגלם. חיסור זה מבודד את האות הספציפית הנובעת מהחלבון של עניין (איוריור 2). באמצעות השינוי שתואר לעיל, LRET ניתן להשתמש כדי למדוד את מרחק שינויים בין תורם chelate terbium והבדיקה נוטלים על חלבון, וכך לעקוב אחר שינויי קונפורמציה במצב הפיזיולוגי הקרוב של החלבון ללא הדרישה לטיהור.
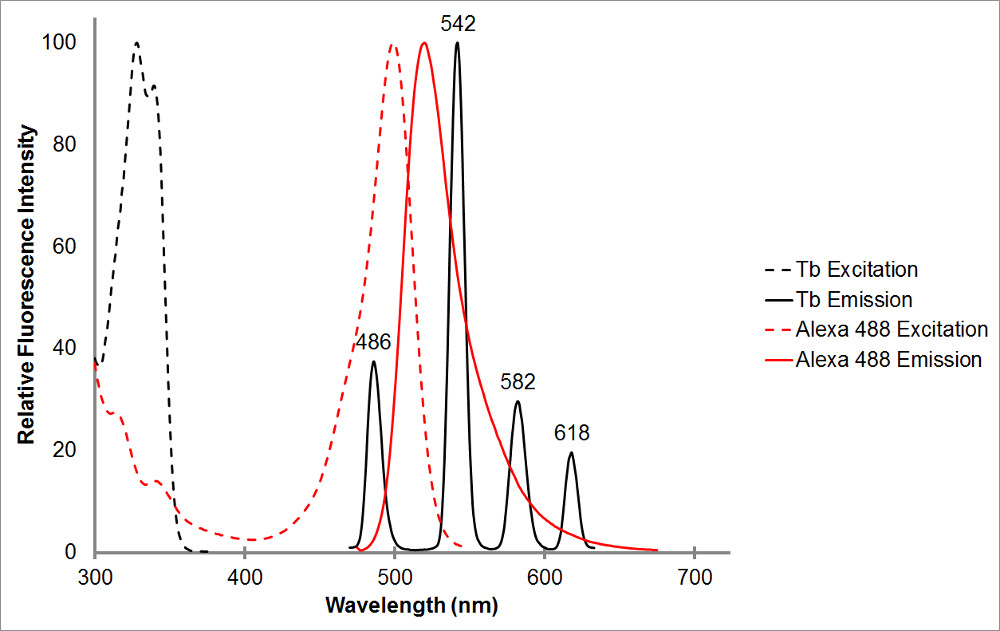
איור 1.The קליטה וספקטרום פליטה של terbium chelated בשחור, כמו גם acceptor נציג, Alexa 488, באדום. שים לב פסגות פליטה מרובות ומגוון החד, צר פליטה עבור כל שיא של chelate terbium. דפוס זה מאפשר לterbium לשימוש עם מגוון רחב של fluorophores acceptor ומאפשר המדידה של פליטה רגיש בתוך אלה טווחים בי terbium לא מראה פליטה. שיא הפליטה של Terbium ב486 ננומטר חופף היטב עם שיא bsorption של Alexa 488, המאפשר העברת אנרגיית התהודה להתרחש בין שני fluorophores. אורך גל של 515 ננומטר הוא בחירה מצוינת לגילוי פליטה רגיש לזוג הזה כפי שהוא בעמק שבין פסגות פליטת terbium, ודי קרוב של Alexa 488 שיא פליטה של 520 ננומטר. שים לב כי ננומטר להיות ליד שיא acceptor, אם כי רצוי, אינו נדרש-565 הוא עדיין מסוגל לזהות פליטת Alexa 488 בלי גם גילוי פליטת terbium.
| Acceptor Fluorophore | R 0 (א) | פליטת גל (ננומטר) |
| Atto 465 | 36 | 3px; "> 508|
| והעמסת | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
טבלת 1 רשימה של fluorophores acceptor הנפוץ לLRET באמצעות chelate terbium כתורם 11. 0 ערכי R נמדדו כאשר התורם acceptor צורפו לתחום מחייב אגוניסט המסיס של קולטני AMPA. הוא אידיאלי כדי למדוד את ערך R 0 שוב לנחקרת כל מערכת חדשה.
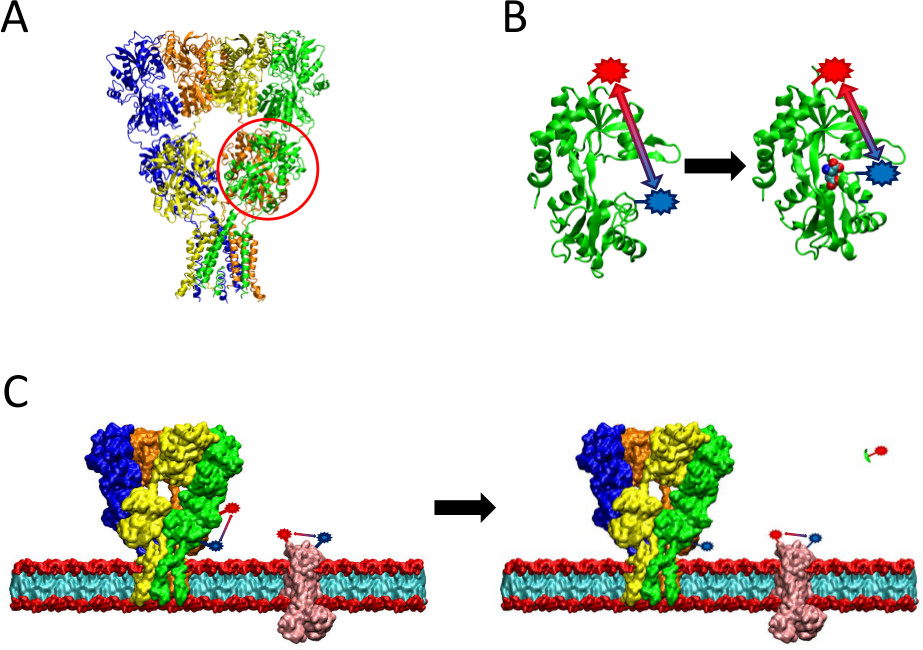
איור 2 סקירה כללית של שיטת LRET הציגה. () קולטן AMPA הוא חלבון קרום שעובר שינויי קונפורמציה על הכריכה ליגנד. ליגנד דו בצורת הצדפהתחום nding הוא הקיף כאן באדום. (ב) תחום מחייב ליגנד של AMPA כאשר אינם מחויבת לחלבון קיים בקונפורמציה פתוחה (משמאל). כאשר חייב יגנד גלוטמט, החלבון סוגר סביב יגנד (מימין). על ידי הצבת fluorophores באתרים הראייתית על LBD, טיבו של שינוי קונפורמציה זו ניתן לראות את המרחק בין שינויי fluorophores, אז שישפיעו על כל החיים הקרינה. (ג) כאשר כל תאי תיוג, תיוג של שני החלבון של עניין, כמו גם חלבוני קרום רקע עלול להתרחש (משמאל). לאחר מחשוף פרוטאז, אות LRET מהחלבון של עניין תיעלם עקב השחרור של בר מסיס, עוזב אות רקע שלם (מימין). אות רקע אז זה יכול להיות מופחתים אות הגלם.
Protocol
Representative Results
Discussion
LRET היא טכניקה רבת עוצמה המאפשרת למדענים למדוד מרחקים בין תחומים בתוך חלבון יחיד, כמו גם בין תת יחידות בחלבון Multimeric. ככזה, LRET הוא מתאים היטב לבחינת השינויים ודינמיקת קונפורמציה של חלבונים או מקרומולקולות אחרות. הפרוטוקול הנ"ל צריך לאפשר מעבדה מצוידת כראוי כדי לבחון…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי המכון הלאומי לבריאות גרנט GM094246, איגוד לב האמריקאי גרנט 11GRNT7890004, והקרן הלאומי למדע גרנט MCB-1,110,501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Riferimenti
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochimica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

