Luminescence Resonance Energy Transfer allo Studio conformazionale Cambiamenti nella membrana proteine espresse in cellule di mammifero
Summary
Descriviamo qui un metodo migliorato di trasferimento Luminescence Resonance Energy (lRet) dove introduciamo un sito proteasi scissione tra i siti fluoroforo donatore e accettore. Questa modifica ci permette di ottenere segnali lRet specifici derivanti dalle proteine di membrana di interesse, consentendo lo studio di proteine di membrana, senza purificazione della proteina.
Abstract
Trasferimento Luminescence Resonance Energy, o lRet, è una potente tecnica utilizzata per misurare le distanze tra due siti nelle proteine all'interno della gamma distanza di 10-100 Å. Misurando le distanze in diverse condizioni legatura, cambiamenti conformazionali della proteina possono essere facilmente valutati. Con lRet, un lantanidi, terbio il più delle volte chelato, è utilizzato come fluoroforo donatore, offrendo vantaggi quali una maggiore durata unico donatore-emissione, la flessibilità di utilizzare più fluorofori accettore, e la possibilità di rilevare le emissioni accettore sensibilizzata come un modo semplice misurare trasferimento di energia senza il rischio di rilevare anche solo segnali donatori. Qui, descriviamo un metodo per utilizzare lRet sulle proteine di membrana espresse e testati sulla superficie delle cellule di mammifero intatte. Introduciamo un sito proteasi scissione tra la coppia fluoroforo lRet. Dopo aver ottenuto il segnale lRet originale, scissione in quel sito rimuove il segnale lRet specifica proteina diinteresse che ci permette di sottrarre quantitativamente il segnale di fondo che rimane dopo la scissione. Questo metodo consente una più fisiologicamente rilevanti misurazioni da effettuare, senza la necessità di purificazione di proteine.
Introduction
Trasferimento Luminescence Resonance Energy (lRet) è un derivato del ben noto Fluorescence Resonance Energy Transfer (FRET) tecnica 1. Simile a preoccuparsi, lRet può essere utilizzato per misurare le distanze e le variazioni di distanza tra fluorofori donatore e accettore collegati a siti specifici sulla proteina di interesse all'interno della gamma di 10-100 Å 1-3. I principi della lRet sono simili a FRET dal fatto che il trasferimento di energia di risonanza si verifica tra due fluorofori prossimali quando lo spettro di emissione del fluoroforo donatore si sovrappone con lo spettro di assorbimento del fluoroforo accettore. L'efficienza di questo trasferimento è correlata alla distanza tra i due fluorofori dalla seguente equazione:
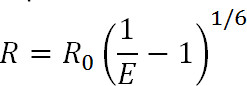 Eq. 1
Eq. 1
dove R è la distanza tra i due fluorofori, E è l'efficienza di entrasferimento ERGIA, e R 0, discusso in seguito, è il raggio Förster per la coppia fluoroforo, cioè la distanza alla quale l'efficienza di trasferimento è a metà-massimale. Da questa equazione, si può vedere che l'efficienza è legata alla grandezza della distanza elevato alla sesta potenza inversa 1. E 'questo inversa sesto dipendenza potenza che permette di FRET e misurazioni lRet essere squisitamente sensibile anche a piccole variazioni di distanza, quando nei pressi della R 0 della coppia FRET. La capacità di etichettare specificamente i siti desiderati sulle proteine o altre macromolecole permette di approfittare di questa sensibilità per monitorare i cambiamenti conformazionali.
Rispetto al FRET, che utilizza molecole di colorante organiche convenzionali, lRet offre ulteriori vantaggi. In lRet, invece di utilizzare un colorante organico come fluoroforo donatore, un catione serie dei lantanidi, tipicamente Tb 3+ o Eu 3 +, viene utilizzato 1,4-6. Fluorofori che cadono uTEDS questa categoria, per esempio, terbio chelato, sono anche molto versatile in quanto possono essere utilizzati con una vasta gamma di fluorofori accettori. Tale flessibilità è possibile perché gli spettri di emissione dei lantanidi chelati contenere più picchi di emissione taglienti, consentendo una singola specie di fluoroforo donatore per essere utilizzato con uno di una vasta gamma di fluorofori accettori. Così, emissione accettore sensibilizzati può essere rilevato senza alcun timore di contaminare sanguinare-through da emissioni donatore 5. Lo sperimentatore seleziona il accettore specifico in base alla distanza prevista tra i due fluorofori (Figura 1 e Tabella 1). In questi fluorofori lantanidi chelati, lo ione metallico è chelato da una molecola contenente un gruppo antenna che sensibilizza il lantanide normalmente scarsamente assorbente all'eccitazione e un gruppo funzionale bioreactive per legare lo ione di un gruppo funzionale specifico sulla macromolecola 1, 5,6. Once eccitato, lantanidi rilassarsi allo stato fondamentale mediante il rilascio di fotoni, con un tasso di decadimento dell'ordine del millisecondo. Poiché il decadimento è né un rilassamento singoletto a singoletto né un rilassamento tripletto a singoletto, l'emissione di fotoni può non essere correttamente chiamato fluorescenza o fosforescenza, ma è più propriamente definito luminescenza 1. La lunga decadenza di lantanidi luminescenza aiuta molto nelle misurazioni a vita. Misurazioni Lifetime possono quindi essere utilizzati per determinare l'efficienza tramite la seguente relazione:
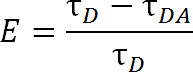 Eq. 2
Eq. 2
dove E è l'efficienza del trasferimento, τ D è la durata del donatore (lantanidi chelato) quando non partecipano al trasferimento di energia, e τ DA è la durata del donatore quando partecipano a trasferimento di energia con l'accettore. Con lRet, τ DA possibile alin modo da misurare la durata dell'emissione accettore sensibilizzata perché la vita di terbio è tanto più grande di un fluoroforo accettore organico. L'accettore emette con la stessa vita come la sua eccitazione incitamento (lantanidi donatore), e qualsiasi contributo per la durata di vita propria fluorescenza intrinseca del accettore è relativamente trascurabile. Misurando l'emissione sensibilizzata piuttosto che di emissione del donatore, abbiamo anche eliminare la necessità di garantire un'etichettatura esattamente un rapporto 1: 1 di donatore accettore. Proteina può invece essere etichettato contemporaneamente sia con accettatore e fluorofori donatori. Una popolazione eterogenea etichetta si tradurrà, ma proteine marcate doppio donatore non emette nella lunghezza d'onda accettore e proteine marcate doppio-accettore non sarà entusiasta. Inoltre, la distanza tra i fluorofori dovrebbe essere lo stesso, a prescindere da quale cisteina sito un determinato fluoroforo attribuisce a, soprattutto quando si utilizzano i lantanidi isotropi come un donatore, in modo che il need per specificare un determinato sito per ricevere il donatore o accettore non è necessaria. L'intensità può essere affetto da una popolazione eterogenea, ma dovrebbe comunque essere più che sufficiente per essere rilevato.
Nel progettare esperimenti, la scelta di fluorofori dovrebbe essere dettata dal valore R 0 della coppia nonché nell'intervallo previsto distanza da misurare. Il valore R 0 è definito dalla seguente equazione:
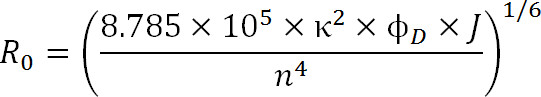 Eq. 3
Eq. 3
dove R 0 è il raggio Förster in Angstrom, κ 2 è il fattore di orientamento tra i due coloranti (di solito assunti per essere 2/3), φ D è la resa quantica del donatore, J è la sovrapposizione spettrale integrale tra il donatore del spettro di emissione e lo spettro di assorbimento del accettore in M – 1cm -1 nm 4, ed n è l'indice di rifrazione del mezzo 1.
Il nostro laboratorio ha aggiunto una modifica alla tecnica convenzionale lRet introducendo un sito di riconoscimento proteasi tra donatore e accettore siti etichette sulla proteina essendo sondato. Questa modifica permette di indagine in sistemi non-purificato come le cellule di mammifero intere 7. Questa tecnica è particolarmente utile quando si utilizzano cisteine come siti per l'etichettatura, poiché nel processo di etichettatura con coloranti maleimmide coniugato che si legano ai gruppi sulfidrilici cisteina, altre proteine sulle cellule che hanno cisteine sono inoltre classificati. Tuttavia, includendo i siti di clivaggio della proteasi sulla proteina di interesse e vite di misura prima e dopo clivaggio, lo sperimentatore può quantitativamente sottrarre il segnale di fondo dopo proteasi scissione dal segnale grezzo. Questa sottrazione isola il segnale specifico derivante dalla proteina di interesse (FigURE 2). Utilizzando la modifica sopra descritta, lRet può essere utilizzato per misurare le variazioni di distanza tra il donatore terbio chelato e la sonda accettore su una proteina, e quindi monitorare i cambiamenti conformazionali stato fisiologico prossimità della proteina senza la necessità di purificazione.
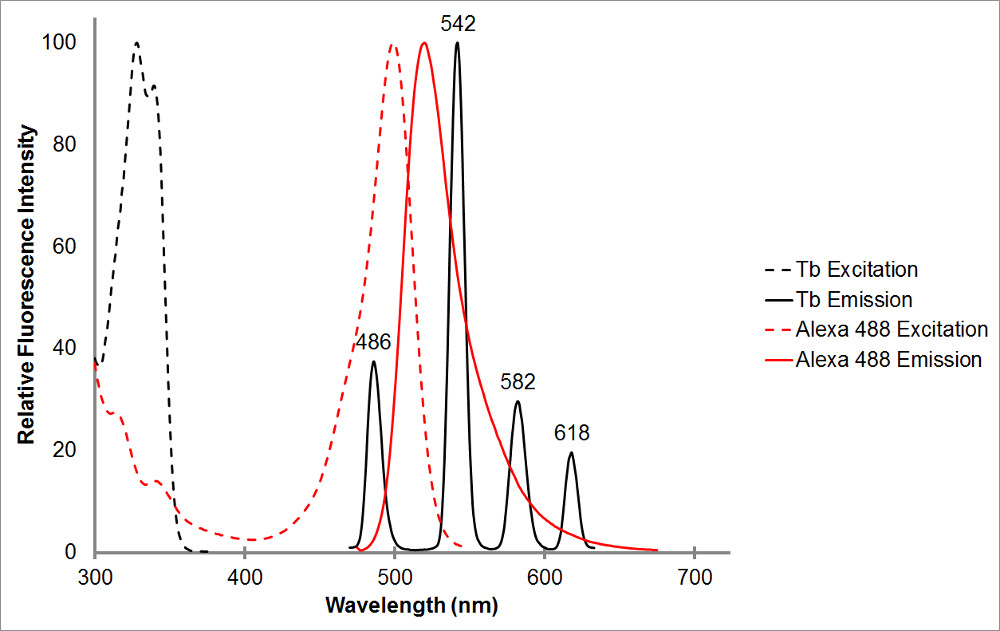
Figura 1.L spettri di assorbimento e di emissione di terbio chelato in nero, così come un accettore rappresentante, Alexa 488, in rosso. Notare i picchi di emissione più e il forte, intervallo di emissione stretto per ogni picco di terbio chelato. Questo modello permette di terbio di essere utilizzato con una varietà di fluorofori accettori e facilita la misurazione delle emissioni sensibilizzati all'interno di tali intervalli in cui terbio mostra nessuna emissione. Picco di emissione di terbio a 486 nm si sovrappone abbastanza bene con l'una picco bsorption di Alexa 488, consentendo il trasferimento di energia di risonanza a verificarsi tra i due fluorofori. Lunghezza d'onda di 515 nm è una scelta eccellente per rilevare le emissioni sensibilizzati per questa coppia, come è nella valle tra i picchi di emissione terbio, e abbastanza vicino picco di Alexa 488 di emissione di 520 nm. Si noti che essendo vicino al picco accettore, anche se auspicabile, non è necessaria-565 nm è ancora in grado di rilevare Alexa 488 emissione senza anche rilevare emissione terbio.
| Fluoroforo accettore | R 0 (Å) | Emissione lunghezza d'onda (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluoresceina | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tabella 1 Un elenco di fluorofori accettori comunemente usati per lRet utilizzo terbio chelato come il donatore 11. I R 0 valori sono stati misurati quando il donatore e accettore sono state allegate alla agonista dominio di legame solubili dei recettori AMPA. E 'ideale per misurare nuovamente il valore di R 0 per ogni nuovo sistema in fase di studio.
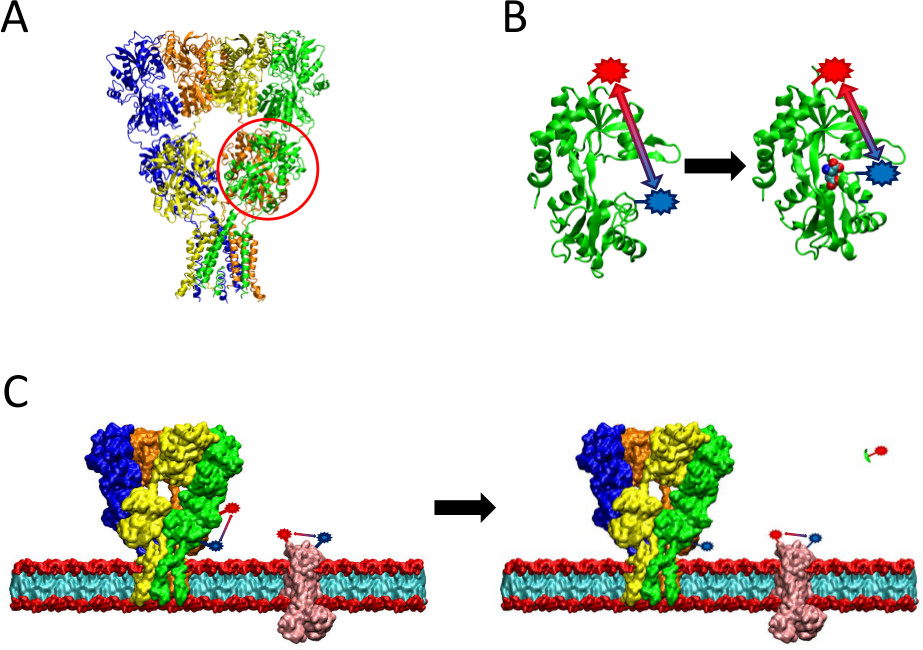
Figura 2 Una panoramica del metodo lRet presentato. (A) Il recettore AMPA è una proteina di membrana che subisce cambiamenti conformazionali upon-ligando. Il ligando-bi-a forma di conchiglianding dominio è cerchiata in rosso qui. (B) Il dominio ligand-legame di AMPA quando non si lega alle proteine esiste in una conformazione aperta (a sinistra). Quando è legato al ligand glutammato, la proteina chiude attorno al suo ligando (a destra). Inserendo fluorofori in siti probatori sul LBD, la natura di questo cambiamento conformazionale può essere visto come la distanza tra i fluorofori modifiche, che poi incidere durata della fluorescenza. (C) Quando etichettatura cellule intere, l'etichettatura sia della proteina di interesse così come le proteine di membrana sfondo si possono verificare (a sinistra). Dopo proteasi clivaggio, segnale lRet dalla proteina di interesse scomparirà a causa del rilascio di un frammento solubile, lasciando intatto sfondo segnale (a destra). Questo segnale di fondo può essere sottratto dal segnale grezzo.
Protocol
Representative Results
Discussion
LRet è una potente tecnica che permette agli scienziati di misurare le distanze tra i domini all'interno di una singola proteina, come pure tra subunità di una proteina multimerica. Come tale, lRet è adatto a esaminare i cambiamenti conformazionali e dinamiche di proteine o altre macromolecole. Il protocollo di cui sopra dovrebbe consentire il laboratorio adeguatamente attrezzato per testare facilmente le loro ipotesi; tuttavia, ci sono molte fonti comuni di errore che possono affliggere il nuovo investigat…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato supportato dal National Institutes of Health di Grant GM094246, l'American Heart Association di Grant 11GRNT7890004, e la National Science Foundation sovvenzione MCB-1110501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Riferimenti
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochimica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

