발광 공명 에너지는 포유 동물 세포에 표현 막 단백질의 구조 변화를 연구에 전송
Summary
우리는 여기에 우리가 기증자와 수용체 형광 사이트 사이의 단백질 분해 효소 절단 부위를 소개 향상된 발광 공명 에너지 전달 (LRET) 방법을 설명합니다. 이 변형은 우리가 단백질의 정제없이 막 단백질의 연구를 허용 관심 막 단백질에서 발생하는 특정 LRET 신호를 획득 할 수있다.
Abstract
발광 공명 에너지 전달, 또는 LRET는, 10 ~ 100 (A)의 거리 범위 내에서 단백질 두 사이트들 사이의 거리를 측정하는 데 사용하는 강력한 기술이다. 다양한 조건 하에서 결찰 거리를 측정함으로써, 단백질의 구조 변화가 용이하게 평가 될 수있다. LRET, 란탄, 대부분 킬레이트 테르븀과 같은 이상 도너 전용 발광 수명 여러 셉터 형광체를 사용할 수있는 유연성 및 쉬운 방법으로서 민감화 셉터 방출을 검출하는 계기로 이점을 수득, 도너 형광 물질로서 사용 또한 도너 전용 신호를 검출하는 위험없이 에너지 전이를 측정한다. 여기서는 막 단백질 발현 및 본래 포유 동물 세포의 표면 상에 정량 LRET를 사용하는 방법을 설명한다. 우리는 LRET의 형광 쌍 사이에 단백질 분해 효소 절단 부위를 소개합니다. 원래 LRET 신호를 얻는 후, 해당 사이트의 단리는 단백질에서 특정 LRET 신호를 제거우리가 정량적으로 절단 후 남아있는 배경 신호를 뺄 수 있도록 관심. 이 방법은 더 중요한 생리 학적 측정은 단백질의 정제를 필요로하지 않고 제작 될 수 있습니다.
Introduction
발광 공명 에너지 전달 (LRET)는 잘 알려진 형광 공명 에너지 전달 (FRET) 기술을 하나의 유도체이다. FRET 마찬가지로, 10-100 LRET는 1-3의 범위 내에서 관심있는 단백질의 특정 위치에 부착 된 도너와 억 셉터 형광체 사이의 거리 및 거리의 변화를 측정하는데 사용될 수있다. LRET의 원리는 도너의 형광 방출 스펙트럼은 셉터 형광체의 흡수 스펙트럼과 중첩 될 때 두 기단 사이에서 발생하는 형광도 공명 에너지 전달에 FRET 유사하다. 이 전사의 효율은 다음 식에 의해이 형광체 사이의 거리와 관련된다 :
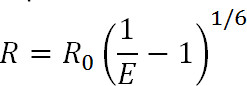 식. 1
식. 1
R은 두 형광체 사이의 거리이고, E는 EN의 효율이다후술 ergy 전송, R 0는, 전사 효율의 반 극대되는 거리 즉 형광 쌍에 대한 포스터 반경이다. 이런 식으로, 하나는 그 효율이 역 여섯째 전원 (1)에 발생하는 거리의 크기에 관련되어 볼 수있다. 이 때 FRET 쌍의 R 공 근처에 아주 작은 거리 변화에 정교하게 민감하게 FRET와 LRET 측정을 위해 허용이 역 여섯째 전력 의존성이다. 특히 단백질이나 다른 고분자에 원하는 사이트에 라벨을 할 수있는 능력은 하나의 구조 변화를 모니터링하기 위해이 감도을 활용할 수 있습니다.
종래의 유기 색소 분자를 사용 FRET, 비교하면, LRET 추가적인 이점을 제공한다. LRET에서는 대신 도너 형광 단, 란탄 족 양이온, 일반적으로 결핵 3+ 또는 Eu를 3 이상으로 유기 색소를 사용하는 1,4-6 사용된다. U 가을 형광파인더이 범주는, 예를 들어, 테르븀 킬레이트는 또한 그들이 수용체의 형광의 넓은 범위에서 사용할 수있는 매우 다양한 있습니다. 란탄 족 킬레이트의 방출 스펙트럼은 다수의 날카로운 발광 피크를 포함하기 때문에 유연성 셉터 형광체의 다양한 중 하나와 함께 사용할 수 도너 형광 물질의 하나의 종을 허용 가능하게된다. 따라서, 감응 형 수용체 방출 기증자 방출 5에서 잘린 오염의 두려움없이 검출 할 수있다. 실험자들은이 형광체 (도 1 및 표 1) 사이의 거리에 기초하여 예상되는 특정 수용체를 선택한다. 이러한 킬레이트 화 란탄 형광체에서, 금속 이온이 고분자 하나의 특정 작용기에 이온 밧줄하기 bioreactive 관능기뿐만 아니라의 여기하는 통상 저조한 흡수 란탄을 민감하게 안테나 그룹을 포함하는 분자에 의해 킬레이트 화된다 5,6. ONC흥분 즉, 란탄 족은 밀리 초 범위의 붕괴 속도와 광자의 방출을 통해 바닥 상태로 이완. 붕괴 중항 투 중항 이완이나 삼중 항 – 대 – 일 중항 이완도 있기 때문에, 광자의 방출이 제대로 형광 또는 인광을 호출 할 수는 없지만, 하나 이상의 발광 적절히 불린다. 란탄 족 발광의 긴 감쇠가 크게 수명 측정에 도움이됩니다. 수명 측정은 다음 관계식을 통해 효율을 결정하는데 사용될 수있다 :
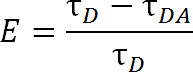 식. 이
식. 이
여기서, E는 전송의 효율이고, τ의 D는 에너지 전달에 참여하지 도너 (킬레이트 화 란탄)의 수명이고, 수용체와의 에너지 전달에 참여하는 경우 τ DA는 도너의 수명이다. LRET으로, 다음 τ의 DA는 알 수테르븀의 수명이 훨씬 더 큰 유기 수용체의 형광보다 때문에 이렇게 감작 된 수용체 방출의 수명으로 측정 될 수있다. 수용체는 선동 여기 (기증자 란탄 족)과 같은 수명을 방출하고, 받아들이 자신의 고유 형광 수명에서 수명에 대한 기여도는 상대적으로 무시할 수있다. 도너 억 셉터에 1 비율 공여자 발광 오히려보다 감응 발광을 측정함으로써, 우리는 또한 정확히 하나에 라벨링을 확보 할 필요성을 제거한다. 단백질 대신 수용체와 기증자 형광 모두를 동시에 표시 할 수 있습니다. 이질 표시 인구가 발생할 수 있지만 두 번 기증자 표지 단백질 수용체의 파장이 발생하지 않 두 번 수용체 표지 단백질이 흥분하지 않습니다. 또한, 형광 물질 사이의 거리에 관계없이 도너로서 등방성 란탄을 이용 특히 주어진 형광 물질이 부착되는 위치의 시스테인, 동일하므로 성은해야d는 기증자 또는 수용체 중 하나가 불필요받을 수있는 특정 사이트를 지정합니다. 강도는 이기종 인구에 영향을 줄 수 있습니다,하지만 여전히 감지하기에 충분한 것보다 더해야합니다.
실험을 계획 할 때, 형광 물질의 선택은 한 쌍의 R 0 값뿐만 아니라, 예상 거리 범위에 의해 결정되어야한다 측정된다. R 0 값은 다음 식으로 정의된다 :
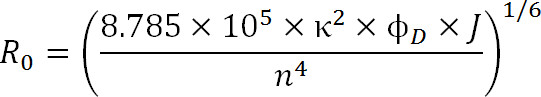 식. 3
식. 3
여기서, R 0는 옹스트롬 포스터 반경이며,이 κ하면 (보통 2/3 것으로 가정)이 염료의 배향 계수는, φ D가 도너의 양자 수율이며, J는 도너의 사이 적분 스펙트럼 오버랩은 M의 발광 스펙트럼과 수용체의 흡광도 스펙트럼 – 1cm -1 내지 4이고, n 매체 (1)의 굴절율이다.
우리 연구소는 검사 대상인 단백질에 기증자 및 수용체 라벨 사이트 사이에 단백질 분해 효소 인식 부위를 도입하여 기존의 LRET 기술에 대한 수정을 추가했다. 이 수정은 모든 포유 동물 세포 7과 같은 비 정제 시스템의 조사를 할 수 있습니다. 시스테인도 표시되어있다 세포 시스테인 설프 하이 드릴 기, 다른 단백질에 결합하는 말레이 미드 공액 염료 라벨링 과정 이후, 표지 용 사이트로 시스테인을 사용하는 경우이 방법이 특히 유용하다. 그러나, 관심있는 단백질에 단백질 분해 효소 절단 부위를 포함하고 전과 후에 절단 수명을 측정함으로써, 실험자 정량적 원시 신호로부터 프로테아제 절단 후의 배경 신호를 감산 할 수있다. 이러한 감산은 (도 관심의 단백질에서 발생하는 특정 신호를 분리우레 2). 상술 한 변형 예를 사용하여, LRET는 테르븀 킬레이트 공여체 및 단백질에 대한 수용체 프로브 사이의 거리의 변화를 측정하고, 이와 같이 정제에 대한 요구없이 단백질의 근처 생리적 상태의 구조 변화를 모니터링하는데 사용될 수있다.
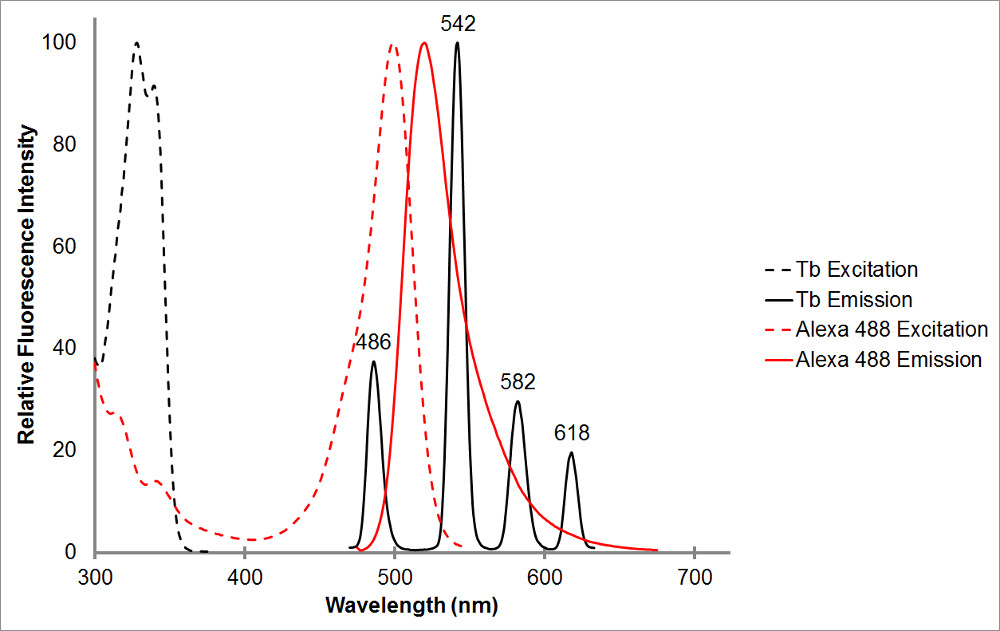
그림 1. 흡수와 검은 색 킬레이트 테르븀뿐만 아니라 빨간색으로 대표 수용체, 알렉사 488의 발광 스펙트럼. 다수의 발광 피크 테르븀 킬레이트의 각 피크에 대한 날카로운 좁은 배출 범위를 알 수 있습니다. 이 패턴이 테르븀 셉터 형광체의 다양한 사용되도록 허용 테르븀 더 발광을 보여주지 그 범위 내에서 민감화 발광의 측정을 용이하게한다. 와 아주 잘 겹쳐 nm의 486에서 테르븀의 발광 피크 이 사이에 발생하는 형광 공명 에너지 전달을 허용 알렉사 488 bsorption 피크. 515 nm의 파장은 테르븀 방출 피크 사이의 골짜기에서, 그리고 확실히 520 nm 인 알렉사 488의 발광 피크 근처로이 쌍 민감화 방출을 탐지하는 우수한 선택이다. 수용체 피크 근처에있는 바람직하지만, 그렇지 필요-565의 나노 여전히 또한 테르븀 방출을 검출하지 않고 알렉사 488 방출을 감지 할 수 있습니다.
| 채택 형광 | R 0 (A) | 방출 파장 (nm) |
| 아토 465 | 36 | 3px; "> (508)|
| 형광 | 45 | 515 |
| 알렉사 488 | 46 | 515 |
| 알렉사 680 | 52 | 700 |
| 알렉사 594 | 53 | 630 |
| 알렉사 555 | 65 | 565 | 를 Cy3 | 65 | 575 |
표 1 LRET 기증자 11로 테르븀 킬레이트를 사용하는 일반적으로 사용되는 수용체의 형광의 목록입니다. 도너 및 억 셉터는 AMPA 수용체의 수용성 작용제 결합 도메인에 연결되었을 때 R 0의 값을 측정 하였다. 그것은 각각의 새로운 시스템이 연구되고 다시 R 0 값을 측정하기에 적합합니다.
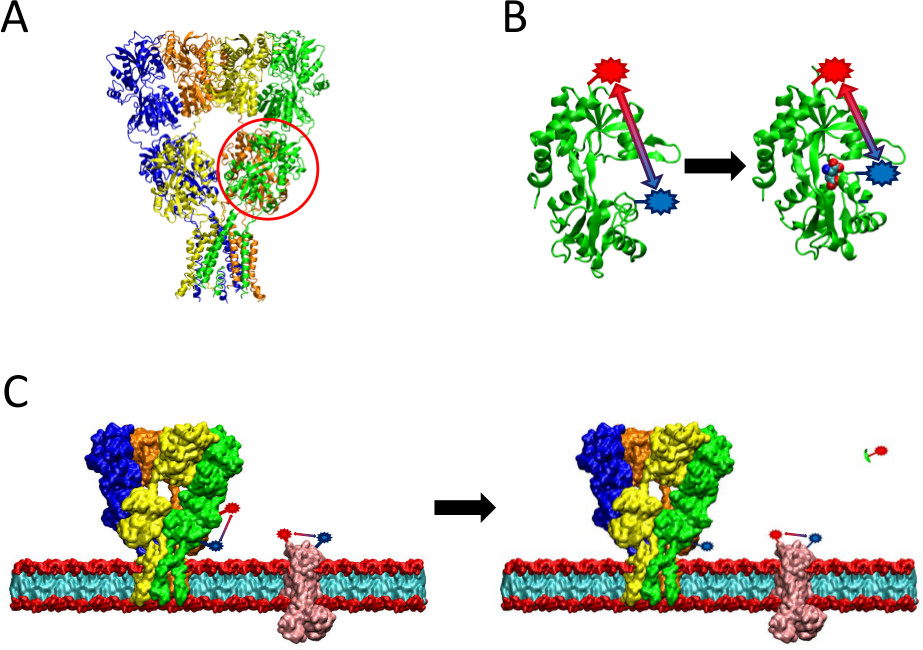
도 2에 제시된 LRET 방법 개요. (A) AMPA 수용체는 리간드 – 결합시에 형태 적 변화를 겪는다 세포막 단백질이다. 대합 조개 껍질 모양의 리간드 – 양방향찾아내는 도메인은 빨간색으로 여기 원으로. (B) 단백질에 결합하지 AMPA의 리간드 결합 도메인은 오픈 형태 (왼쪽)에 존재합니다. 글루타메이트 리간드 바인딩 할 때, 단백질은 리간드 (오른쪽)의 주위에 닫습니다. LBD에 대한 증거가 될 부위에서 형광을 배치하여,이 형태 적 변화의 본성은 형광 수명에 영향을 미칠 것이다 형광 변화 간의 거리로 볼 수있다. (C) 라벨링 전체 세포, 관심의 단백질뿐만 아니라 배경 막 단백질 양의 라벨링 (왼쪽)이 발생할 수있는 경우. 단백질 분해 효소 절단 후, 관심있는 단백질에서 LRET 신호가 배경 신호 그대로 (오른쪽)를 떠나 인해 가용성 단편의 릴리스로 사라집니다. 이러한 배경 신호는 원시 신호로부터 감산 될 수있다.
Protocol
Representative Results
Discussion
LRET 과학자들이 단일 단백질 내에서뿐만 아니라, 다중 체 단백질의 서브 유닛 사이의 도메인 간 거리를 측정 할 수있는 강력한 기술이다. 이와 같이, LRET는 단백질이나 다른 거대 분자의 구조 변화와 역학 조사에 잘 적합합니다. 위의 프로토콜은 쉽게 자신의 가설을 테스트하기 위해 제대로 갖춘 실험실을 허용한다; 그러나 새로운 조사를 괴롭히는 수있는 오류의 많은 일반적인 소스가 있습니다. ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 작품은 건강 부여 GM094246, 미국 심장 협회 (American Heart Association) 그랜트 11GRNT7890004 및 국립 과학 재단의 MCB-1110501의 국립 연구소에 의해 지원되었다.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Riferimenti
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochimica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

