Luminescence Resonance Energy Transfer til Studer konformasjonsendringer i membran proteiner uttrykt i pattedyrceller
Summary
Vi beskriver her en forbedret Luminescence Resonance Energy Transfer (LRET) metode der vi innføre en protease cleavage tomten mellom donor og akseptor fluoroforpar nettsteder. Denne endringen gir oss muligheten til å innhente spesifikke LRET signaler som kommer fra membran proteiner av interesse, slik at for studiet av membran proteiner uten proteinrensing.
Abstract
Luminescence Resonance Energy Transfer, eller LRET, er en kraftfull teknikk som brukes til å måle avstander mellom to steder i proteiner innenfor rekkevidde på 10-100 Å. Ved å måle avstander under forskjellige avsnørede forhold, kan konformasjonsendringer av proteinet lett bli vurdert. Med LRET, et lantanid, oftest chelatert terbium, blir brukt som donor-fluoroforen, hvilket ga fordeler slik som en lengre donor-bare utslipp levetid, fleksibilitet til å bruke flere akseptor fluoroforer, og muligheten til å detektere lysfølsomt akseptor utslipp som en enkel måte å måle energioverføring uten fare for å også å påvise donor-bare signal. Her beskriver vi en fremgangsmåte for å bruke LRET på membranproteiner uttrykt og analysert på overflaten av intakte pattedyrceller. Vi introduserer en protease cleavage nettstedet mellom LRET fluoroforen par. Etter å ha fått den opprinnelige LRET signal, spalting ved det området fjerner den spesifikke LRET signalet fra proteinet avinteresse slik at vi kan kvantitativt trekke bakgrunnen signal som gjenstår etter cleavage. Denne metoden gjør det mulig for mer fysiologisk relevante målinger skal gjøres uten behov for rensing av protein.
Introduction
Luminescence Resonance Energy Transfer (LRET) er et derivat av den velkjente Fluorescence Resonance Energy Transfer (FRET) teknikk en. I likhet med slite, kan LRET brukes til å måle avstander og avstandsendringer mellom donor og akseptor fluoroforene knyttet til bestemte steder på protein av interesse innenfor intervallet 10-100 A 1-3. Prinsippene for LRET er også lik FRET ved at resonans energioverføring skjer mellom to fluoroforer proksimale når emisjonsspekteret av donor fluoroforen overlapper med absorbsjons-spekteret av akseptor fluoroforen. Effektiviteten av denne overføringen er relatert til avstanden mellom de to fluoroforer etter følgende ligning:
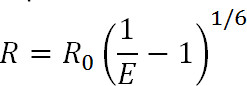 Ekv. 1
Ekv. 1
hvor R er avstanden mellom de to fluoroforer, E er effektiviteten av noErgy overføring, og R 0, omtalt nedenfor, er Förster radius for fluoroforen par, dvs. avstanden som effektiviteten i overføringen er halv maksimal. Fra denne ligning kan man se at effektiviteten er relatert til størrelsen av avstanden opphøyd i inverse sjette strøm 1. Disse inverse sjette strømavhengighet som gir mulighet for FRET og LRET målinger for å være utsøkt følsom selv for små avstandsendringer når nær R 0 av FRET paret. Evnen til å spesifikt merke ønskede steder på proteiner eller andre makromolekyler som tillater en å dra fordel av denne følsomhet til å overvåke konformasjonsendringer.
Sammenlignet med slite, som bruker konvensjonelle organiske fargestoffer, og tilbyr LRET ytterligere fordeler. I LRET, i stedet for ved hjelp av et organisk fargestoff som donor fluorofor, et lantanid-serien kation, typisk Tb 3 + eller 3 + Eu, anvendes 1,4-6. Fluoroforene som faller under denne kategori, f.eks, terbium chelat, er også meget anvendelig ved at de kan brukes sammen med et bredt spekter av akseptor fluoroforer. Denne fleksibiliteten er gjort mulig fordi emisjonsspektrene av chelaterte lanthanider inneholde flere skarpe utslipps topper, slik at for en enkelt art av donor fluoroforen til å brukes sammen med en av et bredt utvalg av akseptor fluoroforer. Dermed kan sensibilisert akseptor utslipp oppdages uten engstelse for å smitte gjennomslag fra donor utslipp fem. Den experimenter velger den spesifikke akseptor basert på den forventede avstanden mellom de to fluoroforer (figur 1 og tabell 1). I disse chelaterte lantanid fluoroforer, blir metallionet chelatert med et molekyl som inneholder en antennegruppe som sensitizes normalt dårlig absorberende lantanid til eksitasjon, så vel som en funksjonell gruppe bioreactive å tjore ion til en bestemt funksjonell gruppe på makromolekylet 1, 5,6. ONCe spent, lanthanider slappe av til grunntilstanden via utgivelsen av fotoner med en dempefaktor i millisekund området. Fordi forfallet er verken en singlet-til-sing avslapping eller en triplett-til-sing avslapning, utslipp av fotoner kan ikke riktig kalles fluorescens eller morilden, men er mer riktig betegnes luminescens en. Den lange nedbrytning av lanthanid luminescence bidrar sterkt i levetid målinger. Levetid målinger kan så brukes for å bestemme effektiviteten via følgende relasjon:
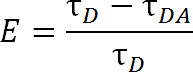 Ekv. 2
Ekv. 2
der, er E effektiviteten i overføringen, er τ D levetiden til donor (kjelatert lanthanid) når de ikke deltar i energioverføring, og τ DA er levetiden til donor når du deltar i energioverføring med akseptor. Med LRET, τ DA kan alså måles som levetiden på lysfølsomt akseptor utslipp fordi terbium levetid er så mye større enn en organisk akseptor fluoroforen. Den akseptor avgir med den samme levetid som dens eggende eksitasjon (donor lantanid), og noe bidrag til levetid fra akseptor egen iboende fluorescens levetid er forholdsvis ubetydelig. Ved å måle den sensibiliserte utslipp fremfor donor utslipp vi også eliminere behovet for å sikre at merkingen på nøyaktig en 1: 1-forhold av donor til akseptor. Protein kan i stedet merkes samtidig med både akseptor og donor fluorophores. Et heterogent merket befolkningen vil føre, men dobbel-donor merkede proteiner vil ikke slippe ut i akseptor bølgelengde og dobbelt akseptor merkede proteiner vil ikke være begeistret. Videre bør avstanden mellom fluoroforer være den samme, uavhengig av hvilken cystein side en gitt fluoroforen er festet til, spesielt ved bruk av den isotrope lanthanider som en donor, så need til å angi et gitt område for å motta enten donor eller akseptor er unødvendig. Intensitet kan påvirkes med en heterogen populasjon, men bør likevel være mer enn tilstrekkelig til å bli detektert.
Ved planlegging av eksperimenter, bør valget av fluoroforer være diktert av R-0-verdi av paret, så vel som de forventede avstandsområde som skal måles. R 0-verdien er definert ved den følgende ligning:
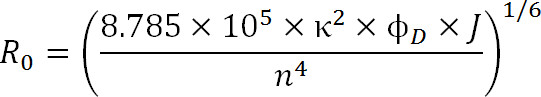 Ekv. 3
Ekv. 3
hvor, R 0 er Förster radius i Ångstrøm, κ 2 er orienteringen faktoren mellom de to fargestoffer (vanligvis antas å være 2/3), φ D er kvanteutbytte av donor, J er den spektrale overlapping integrert mellom donor emisjonsspektrum og akseptor er Absorpsjonsspekteret i M – 1cm -1 nm til 4, og n er brytningsindeksen for mediet 1.
Våre laboratorie har lagt en modifikasjon av den konvensjonelle LRET teknikken ved å innføre en protease-gjenkjenningssete mellom donor og akseptor etikett steder på proteinet som blir undersøkt. Denne modifikasjon gjør det mulig for undersøkelse i ikke-renset systemer som hele pattedyrceller 7. Denne teknikken er spesielt nyttig ved bruk av cysteiner som seter for merking, siden i ferd med merking med maleimide-konjugert fargestoffer som binder seg til cystein-sulfhydrylgrupper, andre proteiner i celler som har cysteiner er også merket. Imidlertid, ved å inkludere proteaseinhibitorer spaltningsseter for proteinet av interesse, og å måle levetider før og etter spalting, experimenter kan kvantitativt subtrahere bakgrunnssignalet etter protease-spalting fra rå signal. Denne subtraksjon isolerer det spesifikke signal som oppstår fra for proteinet av interesse (Figure 2). Ved hjelp av den modifikasjon som er beskrevet ovenfor, kan LRET brukes til å måle avstandsendringen mellom terbium chelat-donor og akseptor sonde på et protein og således overvåke konformasjonsendringer i proteinet, i nærheten av fysiologisk tilstand uten behov for rensing.
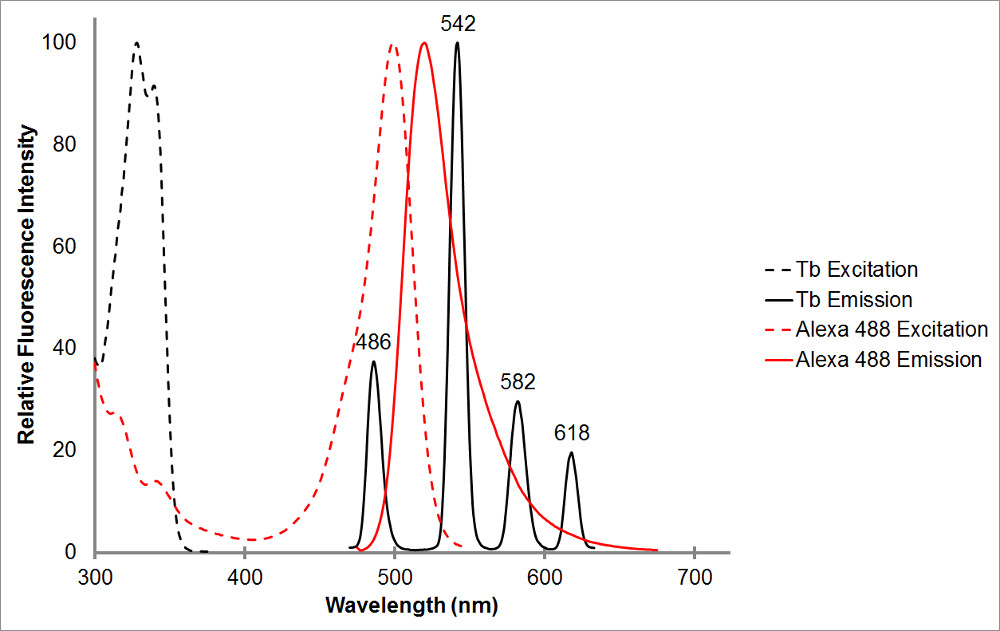
Figur 1. Den absorpsjon og emisjon spektra av chelatert terbium i svart, så vel som en representativ akseptor, Alexa 488, i rødt. Legg merke til de flere utslipps topper og den skarpe, smale emisjonsområde for hver topp av terbium chelat. Dette mønster gjør det mulig for terbium til å brukes sammen med en rekke akseptor fluoroforer og letter måling av lysfølsomt emisjon innenfor avstander hvor terbium viser ingen emisjon. Terbium utslipp topp på 486 nm lapper ganske godt med en bsorption toppen av Alexa 488, slik at for resonans energioverføring å oppstå mellom de to fluoroforer. En bølgelengde på 515 nm er et utmerket valg for å oppdage lysfølsomt utslipp for dette paret som det er i dalen mellom Terbium utslipps toppene, og ganske nær Alexa 488 utslipp topp på 520 nm. Legg merke til at det å være nær akseptor topp, selv om ønskelig, ikke er nødvendig-565 nm er fortsatt i stand til å oppdage Alexa 488 utslipp uten også å oppdage terbium utslipp.
| Akseptant fluoroforen | R 0 (Å) | Utslipp bølgelengde (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluorescein | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tabell 1. En liste over ofte brukte akseptor fluoroforene for LRET bruker terbium chelatet som donor 11. De R-0-verdiene ble målt når donor og akseptor ble festet til den oppløselige agonist bindende domenet av AMPA-reseptorer. Det er ideelt å måle R 0 verdien på nytt for hver nye systemet som studeres.
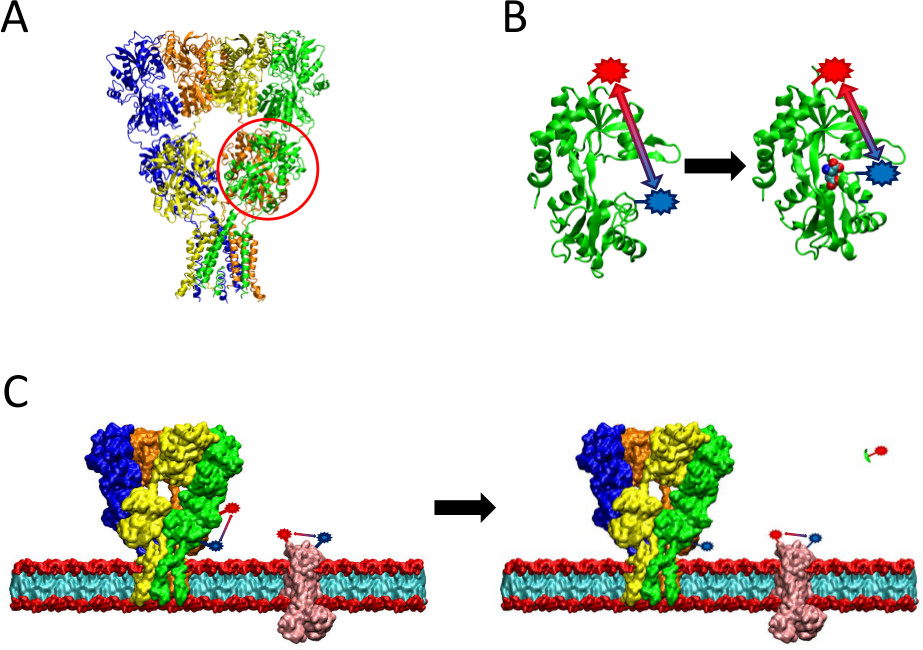
Figur 2. En oversikt over LRET metoden presentert. (A) AMPA-reseptoren er et membranprotein som gjennomgår konformasjonsendringer ved ligand-binding. Clamshell-formet ligand-binding domenet er sirklet her i rødt. (B) Den ligand-bindende domene av AMPA når den ikke er bundet til protein eksisterer i en åpen konformasjon (til venstre). Når bundet til ligand glutamat, lukkes protein rundt sin ligand (høyre). Ved å plassere fluoroforene på probative steder på LBD, kan innholdet i denne konformasjonsendringen sees som avstanden mellom fluoroforene endringer, som da vil påvirke fluorescens levetid. (C) Ved merking av hele celler, kan merking av begge for proteinet av interesse, så vel som bakgrunnsmembranproteiner forekommer (til venstre). Etter spalting protease, vil LRET signal fra proteinet av interesse forsvinner på grunn av frigjøring av et oppløselig fragment, slik at bakgrunnssignal intakt (høyre). Denne bakgrunnssignal kan så bli subtrahert fra det rå signal.
Protocol
Representative Results
Discussion
LRET er en kraftfull teknikk som gjør det mulig for forskere å måle avstander mellom domenene i et enkelt protein, så vel som mellom underenheter i et multimert protein. Som sådan er LRET godt egnet til å undersøke de konformasjonsendringer og dynamikken i proteiner eller andre makromolekyler. Ovennevnte protokoll bør tillate riktig utstyrt lab for enkelt å teste sine hypoteser; Men det er mange vanlige feilkilder som kan plage den nye etterforsker. Hvis liten eller ingen LRET signal er sett, sjekk først bølg…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av National Institutes of Health Grant GM094246, American Heart Association Grant 11GRNT7890004, og National Science Foundation Grant MCB-1110501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Riferimenti
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochimica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

