La luminiscencia de energía de resonancia de transferencia para estudiar cambios conformacionales en proteínas de membrana expresado en células de mamífero
Summary
Se describe aquí un método mejorado de transferencia de energía de resonancia de luminiscencia (LRET) donde se introduce un sitio de escisión de la proteasa entre los sitios de fluoróforo donante y receptor. Esta modificación nos permite obtener señales LRET específicas derivadas de proteínas de la membrana de interés, lo que permite el estudio de las proteínas de membrana sin la purificación de proteínas.
Abstract
Transferencia de Energía de Resonancia de luminiscencia, o LRET, es una técnica poderosa utilizada para medir distancias entre dos sitios en las proteínas dentro de la gama de distancias de 10-100 Å. Mediante la medición de las distancias en diversas condiciones ligadas, los cambios conformacionales de la proteína se pueden evaluar fácilmente. Con LRET, un lantánido, terbio más a menudo quelado, se utiliza como el fluoróforo donante, proporcionando ventajas tales como una mayor vida útil de donantes única emisión, la flexibilidad de utilizar múltiples fluoróforos aceptores, y la oportunidad de detectar emisión del aceptor sensibilizado como una manera fácil para medir la transferencia de energía sin el riesgo de también la detección de la señal de donantes solamente. Aquí se describe un método para utilizar LRET en proteínas de membrana expresadas y ensayados en la superficie de las células de mamífero intactas. Se introduce un sitio de escisión de la proteasa entre el par fluoróforo LRET. Después de obtener la señal LRET original, la escisión en ese sitio elimina la señal LRET específica de la proteína deinterés que nos permite restar cuantitativamente la señal de fondo que queda después de la escisión. Este método permite más fisiológicamente relevantes para mediciones pueden realizar sin la necesidad de purificación de proteína.
Introduction
Transferencia de Energía de Resonancia de luminiscencia (LRET) es un derivado de la técnica bien conocida de transferencia de energía de resonancia fluorescente (FRET) 1. Similar a la FRET, LRET se puede utilizar para medir distancias y los cambios de distancia entre donante y aceptor fluoróforos unidos a sitios específicos en la proteína de interés dentro de la gama de 10-100 Å 1-3. Los principios de LRET son también similares a FRET en que la transferencia de energía de resonancia se produce entre dos fluoróforos proximales cuando el espectro de emisión del fluoróforo donante se solapa con el espectro de absorción del fluoróforo aceptor. La eficiencia de esta transferencia está relacionada con la distancia entre los dos fluoróforos por la siguiente ecuación:
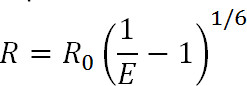 Eq. 1
Eq. 1
donde R es la distancia entre los dos fluoróforos, E es la eficiencia de la norma ENtransferencia ener-, y R 0, se discute a continuación, es el radio de Förster para el par fluoróforo, es decir, la distancia a la que la eficiencia de la transferencia es la mitad de la máxima. A partir de esta ecuación, se puede ver que la eficiencia está relacionada con la magnitud de la distancia elevado a la sexta potencia inversa 1. Es esta dependencia sexta potencia inversa que permite la FRET y las mediciones lRet ser exquisitamente sensible, incluso a pequeños cambios de distancia cuando está cerca del 0 R del par de FRET. La capacidad para etiquetar específicamente sitios deseados en proteínas u otras macromoléculas permite a uno tomar ventaja de esta sensibilidad para monitorizar los cambios conformacionales.
Cuando se compara con FRET, que utiliza moléculas de colorantes orgánicos convencionales, LRET ofrece ventajas adicionales. En LRET, en lugar de utilizar un colorante orgánico como el fluoróforo donante, un catión serie de los lantánidos, normalmente Tb 3 + o Eu 3 +, se utiliza 1,4-6. Los fluoróforos que u caennder esta categoría, por ejemplo, quelato de terbio, son también muy versátil en que se pueden utilizar con una amplia gama de fluoróforos aceptores. Esta flexibilidad es posible porque los espectros de emisión de los lantánidos quelados contienen múltiples picos de emisión agudos, lo que permite una única especie de fluoróforo donante para ser utilizado con una de una amplia variedad de fluoróforos aceptores. Por lo tanto, la emisión aceptor sensibilizado puede ser detectado sin ningún temor a la contaminación de sangrado a través de la emisión de los donantes 5. El experimentador selecciona el aceptor específico basado en la distancia esperada entre los dos fluoróforos (Figura 1 y Tabla 1). En estos fluoróforos lantánidos quelados, el ión metálico es quelado por una molécula que contiene un grupo de antenas que sensibiliza al lantánido normalmente mal de absorción a la excitación, así como un grupo funcional biorreactivo para atar el ion a un grupo funcional específico de la macromolécula 1, 5,6. Once excitado, lantánidos relajarse al estado fundamental a través de la liberación de fotones con una tasa de atenuación en el rango de milisegundos. Debido a que la descomposición es ni una relajación-singlete-singlete ni a una relajación triplete a singlete, la emisión de fotones no puede adecuadamente ser llamado fluorescencia o fosforescencia, pero se denomina más correctamente la luminiscencia 1. La larga decadencia de la luminiscencia de los lantánidos ayuda mucho en las mediciones de toda la vida. Mediciones de por vida se pueden utilizar para determinar la eficacia a través de la siguiente relación:
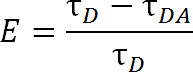 Eq. 2
Eq. 2
donde, E es la eficiencia de la transferencia, τ D es el tiempo de vida del donante (lantánido quelado) cuando no participan en la transferencia de energía, y τ DA es el tiempo de vida del donante cuando se participa en la transferencia de energía con el aceptor. Con LRET, DA τ puede colasí ser medido como el tiempo de vida de la emisión sensibilizada del aceptor debido a la vida de terbio es mucho más grande que un fluoróforo aceptor orgánico. El aceptor emite con la misma vida útil como su excitación incitar (lantánido donante), y cualquier contribución a la vida útil de la propia vida de la fluorescencia intrínseca del aceptor es relativamente insignificante. Mediante la medición de la emisión sensibilizada lugar de emisión del donante, también eliminamos la necesidad de garantizar el etiquetado exactamente en una proporción 1: 1 de los donantes al aceptor. La proteína puede marcarse en lugar simultáneamente con ambos fluoróforos donantes y aceptor. Dará como resultado una población heterogénea marcada, pero las proteínas marcadas con doble donantes no emitirá en la longitud de onda y aceptor proteínas marcadas doble aceptor no le hará ilusión. Por otra parte, la distancia entre fluoróforos debe ser la misma, independientemente de qué sitio cisteína un fluoróforo dado se une a, especialmente cuando se utilizan los lantánidos isotrópicas como un donante, por lo que el need para especificar un sitio determinado para recibir ya sea el donante o aceptor es innecesaria. La intensidad puede ser afectada con una población heterogénea, pero aún debe ser más que suficiente para ser detectado.
Cuando la planificación de los experimentos, la elección de fluoróforos debe ser dictado por el valor de R 0 de la pareja, así como el rango de distancia esperada que está siendo medido. El valor de R 0 se define por la siguiente ecuación:
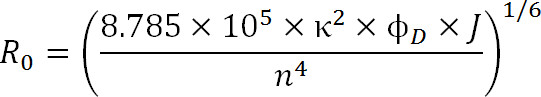 Eq. 3
Eq. 3
donde, R 0 es el radio de Förster en Angstroms, κ 2 es el factor de orientación entre los dos colorantes (se asume que son 2/3), φ D es el rendimiento cuántico del donante, J es el solapamiento espectral integral entre el donante de espectro de emisión y el espectro de absorbancia del aceptor en M – 1cm -1 nm 4, y n es el índice de refracción del medio 1.
Nuestro laboratorio ha añadido una modificación a la técnica convencional LRET mediante la introducción de un sitio de reconocimiento de proteasa entre los sitios donador y aceptor de etiquetas en la proteína que se probaron. Esta modificación permite la investigación en sistemas no-purificada tales como células de mamífero enteros 7. Esta técnica es particularmente útil cuando se utiliza cisteínas como sitios para el etiquetado, ya que en el proceso de etiquetado con tintes-maleimida conjugado que se unen a los grupos sulfhidrilo de cisteína, otras proteínas en las células que tienen cisteínas también se marcan. Sin embargo, mediante la inclusión de sitios de escisión de la proteasa de la proteína de interés y la medición de tiempos de vida antes y después de la escisión, el experimentador puede restar cuantitativamente la señal de fondo después de la escisión de la proteasa a partir de la señal sin procesar. Esta resta aísla la señal específica derivada de la proteína de interés (FigUre 2). Uso de la modificación descrita anteriormente, LRET se puede utilizar para medir los cambios de distancia entre el donante de quelato de terbio y la sonda aceptora en una proteína, y así vigilar los cambios conformacionales en estado fisiológico cerca de la proteína sin el requisito para la purificación.
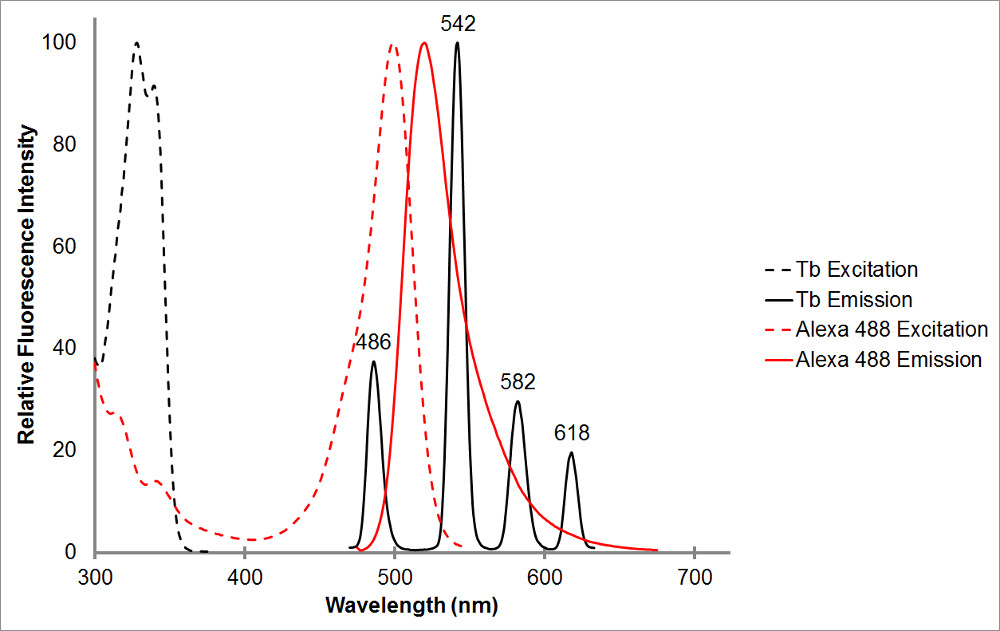
Figura 1.El absorción y espectros de emisión de terbio quelado en negro, así como un aceptor de representante, Alexa 488, en rojo. Observe los múltiples picos de emisión y el, estrecho rango de emisión para cada pico agudo de quelato de terbio. Este patrón permite terbio para ser utilizado con una variedad de fluoróforos aceptores y facilita la medición de la emisión sensibilizada dentro de esos rangos, donde terbio muestra ninguna emisión. Pico de emisión del terbio a 486 nm se superpone bastante bien con el de un pico bsorption de Alexa 488, lo que permite la transferencia de energía de resonancia que se produzca entre los dos fluoróforos. Una longitud de onda de 515 nm es una excelente elección para detectar la emisión sensibilizada para este par, ya que es en el valle entre los picos de emisión terbio, y bastante cerca de pico de emisión de Alexa 488 de 520 nm. Tenga en cuenta que estar cerca del pico de aceptor, aunque deseable, no se requiere-565 nm es todavía capaz de detectar emisión de Alexa 488 sin también detectando la emisión de terbio.
| Fluoróforo aceptor | R 0 (Å) | Longitud de onda de emisión (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluoresceína | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tabla 1. Una lista de fluoróforos aceptores usados comúnmente para LRET usando quelato de terbio como donante 11. Se midieron los valores de R 0 cuando el donante y el aceptor se unen al dominio de unión del agonista soluble de los receptores AMPA. Es ideal para medir el valor de R 0 de nuevo para que se estudió cada nuevo sistema.
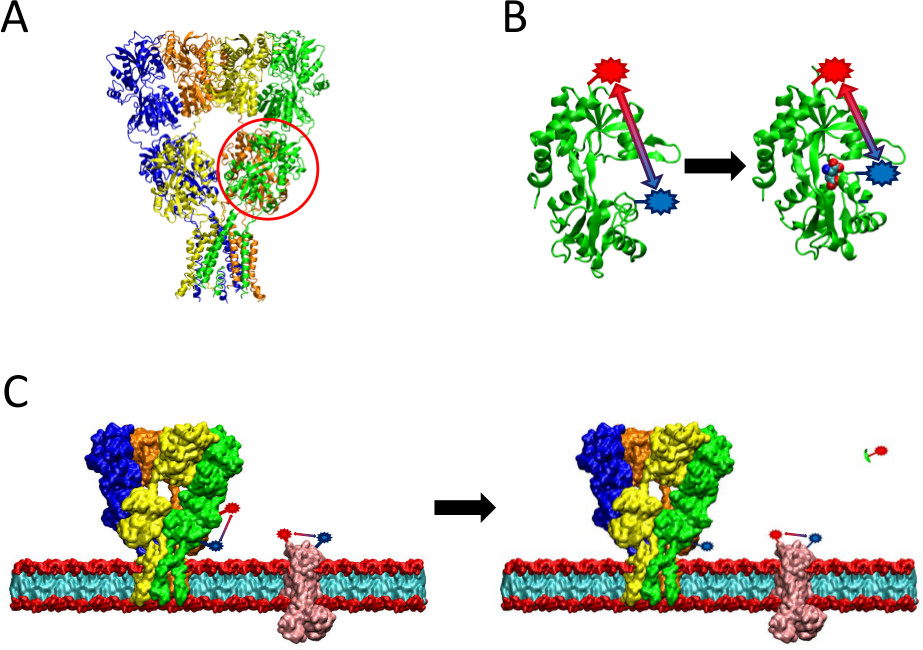
Figura 2 Una visión general del método LRET presentado. (A) El receptor AMPA es una proteína de membrana que sufre cambios conformacionales a ligando vinculante. El ligando bi-en forma de concha de almeja-dominio hallazgo es un círculo aquí en rojo. (B) Existe el dominio de unión al ligando del AMPA cuando no se une a las proteínas en una conformación abierta (izquierda). Cuando se une a ligando de glutamato, la proteína se cierra alrededor de su ligando (derecha). Mediante la colocación de los fluoróforos en los sitios probatorios en el LBD, la naturaleza de este cambio conformacional puede ser visto como la distancia entre los fluoróforos cambios, que luego afectar de vida de fluorescencia. (C) Cuando, pueden ocurrir etiquetado tanto de la proteína de interés, así como proteínas de membrana fondo etiquetado células enteras (izquierda). Después de la escisión de la proteasa, la señal de LRET de la proteína de interés desaparecerá debido a la liberación de un fragmento soluble, dejando intacta la señal de fondo (derecha). Esta señal de fondo puede entonces ser sustraída de la señal sin procesar.
Protocol
Representative Results
Discussion
LRET es una técnica poderosa que permite a los científicos para medir distancias entre dominios dentro de una única proteína, así como entre las subunidades en una proteína multimérica. Como tal, LRET está bien adaptado para el examen de los cambios conformacionales y dinámica de las proteínas u otras macromoléculas. El protocolo anterior debe permitir el laboratorio debidamente equipado para probar fácilmente sus hipótesis; Sin embargo, hay muchas fuentes comunes de error que pueden plagar el nuevo investi…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Esta labor fue apoyada por los Institutos Nacionales de Salud de subvención GM094246, la American Heart Association Beca 11GRNT7890004, y la Fundación Nacional de Ciencia de subvención MCB-1110501.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Riferimenti
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochimica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

