Lüminesans Rezonans Enerji memeli hücrelerinde ifade Membran Proteinleri Konformasyonel Değişiklikleri Eğitim transfer
Summary
Biz burada bir verici ve alıcı florofor siteleri arasında bir proteaz bölünme mevkisinin katılması, geliştirilmiş bir lüminesans Rezonans Enerji Transferi (LRET) yöntemini tarif etmektedir. Bu tadilat ile proteinlerin arıtılmadan zar proteinlerinin çalışmaya izin ilgi zar proteinleri, ortaya çıkan spesifik LRET sinyalleri elde edilmesine olanak sağlamaktadır.
Abstract
Lüminesans Rezonans Enerji Transferi, ya LRET, 10-100 Å mesafe aralığındaki proteinlerin iki site arasındaki mesafeleri ölçmek için kullanılan güçlü bir tekniktir. Çeşitli koşullar altında bağlandı mesafelerin ölçülmesi ile, proteinin konformasyonel değişiklikleri kolayca değerlendirilebilir. LRET, bir lantanid, en sık şelatlı Terbiyum ile, böyle uzun bir donör sadece emisyon ömür, birden fazla alıcı florosforlar kullanmak için esneklik ve kolay bir yol olarak hassaslaşmış akseptör emisyon tespit etmek için fırsat olarak avantajlar sağlamaktadırlar, donör flüorofor olarak kullanılır Ayrıca, verici-tek sinyali tespit riski olmadan enerji transferi ölçülür. Burada, zar proteinleri ifade dokunulmamış memeli hayvan hücrelerinin yüzeyi üzerinde analiz ile LRET kullanmak için bir yöntem tarif eder. Biz LRET florofor çifti arasında bir proteaz bölünme mevkisinin katılması. Orijinal LRET sinyali aldıktan sonra, bu bölgede bölünme kapsamındaki proteinden gelen spesifik LRET sinyalini ortadan kaldırırBize nicel bölünmesinden sonra kalan arka plan sinyali çıkarmak için izin ilgi. Bu yöntem, daha fazla fizyolojik olarak ilgili ölçüm değerlerinin proteinin saflaştırılması için gerek kalmadan yapılmasına izin verir.
Introduction
Lüminesans Rezonans Enerji Transferi (LRET) iyi bilinen bir flüoresan rezonans enerji transferi (FRET) tekniği 1 bir türevidir. FRET benzer şekilde, 10-100 LRET 1-3 aralığında ilgilenilen proteinin üzerinde özel sahalara bağlı verici ve alıcı florofor arasındaki mesafeler ve mesafe değişiklikleri ölçmek için kullanılabilir. LRET ilkeleri, donor-florofor emisyon spektrumu halinde akseptör-florofor emme spektrumu ile üst üste bindiğinde, iki florofor arasındaki yakın meydana Ayrıca rezonans enerji transferi FRET benzerdir. Bu transfer verimi aşağıdaki denklem ile, iki florofor arasındaki mesafe ile alakalıdır:
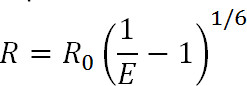 Denk. 1
Denk. 1
R, iki florofor arasındaki mesafedir, E en verimliliğidirAşağıda tartışıldığı ji transferi ve R, 0, transfer verimi yarı maksimal olduğundaki mesafe örneğin flüorofor çifti için Förster yarıçapı vardır. Bu denklemden, bir o verim ters altıncı güç 1 yükseltilmiş mesafenin büyüklüğü ile ilgilidir görebilirsiniz. Bu zaman FRET çiftinin R 0 yakın hatta küçük mesafe değişikliklere zarif duyarlı olmaya FRET ve LRET ölçümler sağlar bu ters altıncı güç bağımlılığıdır. Özellikle proteinlerden veya diğer makromoleküllerden üzerinde arzu edilen the etiketlenebilmesi, bir yapısal değişimleri izlemek için bu duyarlılığının avantajından yararlanmak için izin verir.
Geleneksel organik boya molekülünü kullanan FRET, karşılaştırıldığında, LRET ilave avantajlar sunmaktadır. LRET ise, aksine, donor-florofor, bir lantanid serisi katyon, tipik olarak, Tb 3 + veya 3 + AB gibi bir organik boya kullanarak, 1,4-6 kullanılır. U düşmek Flüoroforlarnder Bu kategori, örneğin, terbium kelatı, ki bu da alıcı Flüoroforlann geniş bir yelpazede kullanılabilecek çok yönlü. Şelatlanmış lantanit emisyon spektrumu çok keskin bir emisyon tepe noktaları içeren, bu esneklik, alıcı florofor çeşitli biri ile kullanılacak olan donor-florofor ait tek bir türün izin veren, mümkün olmaktadır. Böylece, duyarlı alıcı emisyon donör emisyon 5 den sızdırma-through kirlenmesine neden korkusu olmadan tespit edilebilir. Deneyci, iki florofor (Şekil 1 ve Tablo 1) arasındaki mesafeye göre beklenen spesifik akseptörü seçer. Bu şelat lantanid florofor olarak, metal iyonu, makromolekül 1 belirli bir fonksiyonel gruba iyonu halata bir bioreactive işlevsel grup hem de uyarım, normal olarak zayıf emici lantanid duyarlı hale bir anten grubu içeren bir molekül ile kenetlenmiştir, 5,6. Oncheyecanlı e lantanit milisaniye mertebesinde bir çürüme oranı ile fotonların serbest bırakılması ile zemin durumuna rahatlayın. Çürüme bir tekli-to-tekli gevşeme ne de üçüz-to-tekli gevşeme ne olduğundan, fotonların emisyon düzgün flüoresan veya fosfor denilen olamaz, ama daha düzgün bir aydınlık 1 denir. Lantanide luminesansın uzun çürük büyük ölçüde ömrü ölçümleri yardımcı olur. Ömür ölçümler, daha sonra aşağıdaki ilişki ile verimliliğini belirlemek için kullanılabilir:
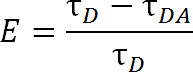 Denk. 2
Denk. 2
nerede, E transferi verimliliği, τ D enerji transferi katılmayan donör (şelatlı lantanide) ömrü ve alıcısı ile enerji transferi katılan zaman τ DA donörün ömrü. LRET ile, τ DA al canterbium yaşam süresi çok daha büyük bir organik akseptör-floroforu daha uzun olduğundan çok hassaslaştırılmış alıcı emisyonunun ömrü olarak ölçülür. Alıcı onun kışkırtmaktan uyarma (donör lantanit) gibi aynı ömrü ile yayar ve akseptör kendi içsel floresan ömür boyu ömür boyu herhangi bir katkısı nispeten ihmal edilebilir düzeydedir. Akseptörüne donör: 1 oranında yerine donör emisyon daha duyarlı emisyonunu ölçerek, biz de tam bir 1'de etiketleme sağlamak için gereksinimini ortadan kaldırır. Protein yerine alıcısı ve verici fluoroforlar hem de aynı anda etiketli olabilir. Bir heterojen olarak etiketli nüfus sonuçlanır, ancak çift verici etiketli proteinler, alıcı dalga boyunda vermeyecek ve çift alıcı etiketli proteinler heyecan olmayacaktır. Ayrıca, florofor arasındaki mesafe, verici olarak bir izotropik lantanidler kullanarak, özellikle belirli bir flüorofor, takılan bu sistein Alanı, aynı olabilir, bu nedenle J`o`kfl olmalıdırd donör veya alıcı ya gereksiz almak için belirli bir siteyi belirtmek için. Şiddeti bir heterojen bir nüfusa sahip etkilenebilir, ama hala tespit edilecek yeterli daha fazla olmalıdır.
Denemelerin planlaması zaman florofor seçimi çiftinin R, 0 değeri hem de beklenen mesafe aralığı tarafından dikte edilmelidir ölçülmüştür. R, 0 değeri, aşağıdaki denklem ile tanımlanır:
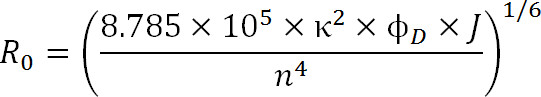 Denk. 3
Denk. 3
burada, R, 0 Angstrom olarak Förster yarıçapı, 2 κ (genellikle 2/3 olduğu varsayılır) iki boyalar arasındaki yönlendirme faktördür φ D donör kuantum verimi, J donörün arasında entegral bir spektral örtüşme M emisyon spektrumu ve akseptör en absorbans spektrumu – 1cm-1 mil 4, ve n, 1 ortamın kırılma indisidir.
Bizim laboratuar inceleniyoruz protein üzerindeki donör ve akseptör etiket siteleri arasında bir proteaz tanıma sitesi eklenmesi ile geleneksel LRET tekniğe bir değişiklik eklemiştir. Bu modifikasyon gibi bütün olarak memeli hücreleri gibi non-7 arıtıldı sistemlerde araştırma sağlar. Sistein de etiketli olan hücrelerde sistein sülfhidril grupları, diğer proteinlere bağlanan maleimid-konjüge boyalar ile etiketleme işleminde bu yana, etiketleme için yerler olarak sistein kullanılırken bu teknik, özellikle yararlıdır. Bununla birlikte, ilgi konusu bir protein üzerinde bir proteaz bölünme mevkilerini de dahil olmak üzere ve daha önce ve bölünmeden sonra ömürleri ölçülerek deneyi kantitatif ham sinyalinden proteaz bölünme sonra arka plan sinyalini çıkarmak olabilir. Bu çıkarma (Şek ilgilenilen proteinin kaynaklanan belirli bir sinyal izoleure 2). Yukarıda tarif edilen değiştirilmiş bir biçimi kullanılarak, LRET terbiyum şelat verici ve bir protein üzerindeki alıcı sonda arasındaki mesafe değişiklikleri ölçmek ve dolayısıyla saflaştırma için ihtiyaç duyulmadan, proteinin yaklaşık olarak fizyolojik halde yapısal değişimleri izlemek için de kullanılabilir.
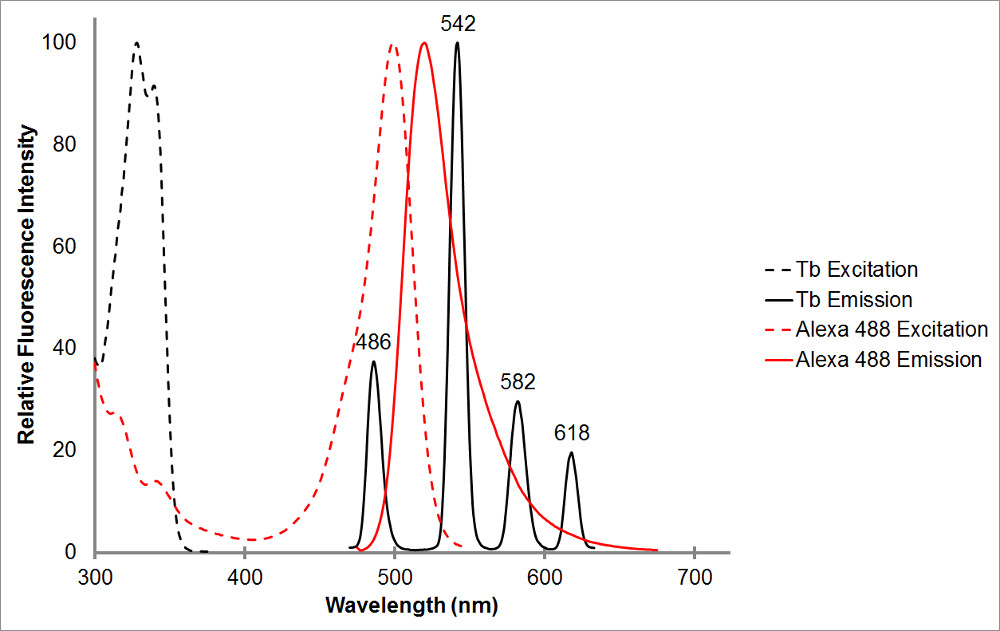
Şekil 1.The emme ve siyah şelatlı terbiyum, hem de kırmızı temsili bir alıcı, Alexa 488, emisyon spektrumu. Birden fazla emisyon tepe ve terbiyum çelatın her bir zirve için keskin, dar yayma özelliğine edin. Bu model, terbiyum alıcı florofor ile birlikte kullanılabilir mümkün kılar ve terbiyum yayılıma gösterir, bu aralıklar içinde, duyarlı emisyon ölçümü kolaylaştırır. A ile oldukça iyi örtüşüyor nm 486 de Terbiyum emisyon zirve iki flüorofor arasındaki meydana rezonans enerji transferi için izin Alexa 488 bsorption pik. 515 nm dalga bu terbiyumun emisyon zirveleri arasında vadi içinde ve oldukça 520 nm Alexa 488 emisyon zirvesine yakın olarak bu çifti için hassaslaşmış emisyonu tespit etmek için mükemmel bir seçimdir. Alıcı zirveye yakın olmak, arzu olsa, değil gerekli-565 nm de hala terbiyumun emisyonu tespit olmadan Alexa 488 emisyonu tespit edebildiğini unutmayın.
| Akseptör-florofor | R 0 (Å) | Emisyon dalgaboyu (nm) |
| Atto 465 | 36 | 3px; "> 508|
| Fluorescein | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 | Cy3 | 65 | 575 |
Tablo 1. LRET donör 11 olarak terbiyumun şelatını kullanmak için yaygın olarak kullanılan alıcı Flüoroforlann listesi. Verici ve alıcı, AMPA reseptörlerinin çözünür agonist bağlanma alanına bağlı zaman R, 0 değerleri ölçüldü. Her yeni sistem çalışılan tekrar R 0 değerini ölçmek için idealdir.
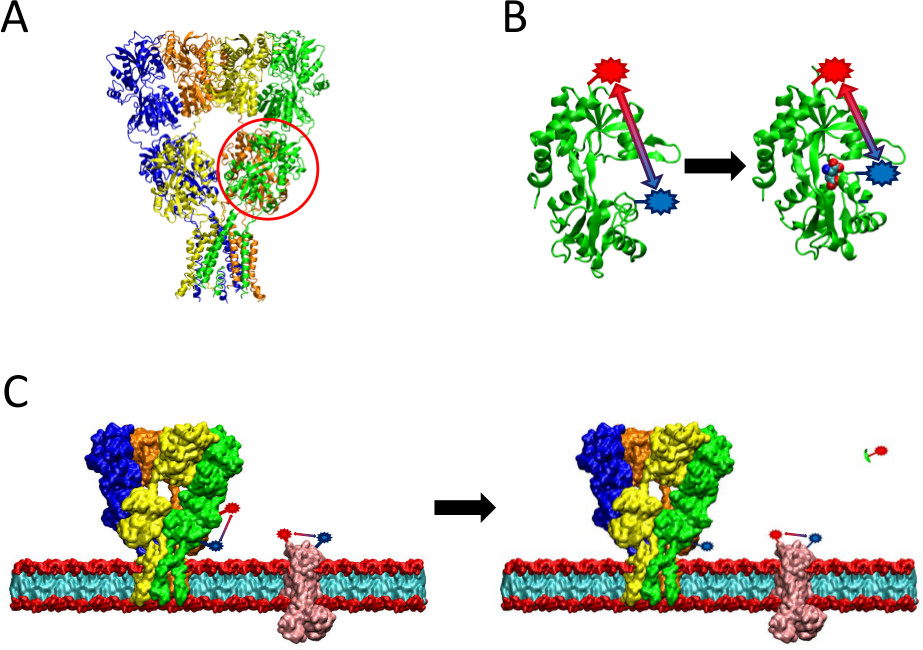
Şekil 2. sunulan LRET yöntemin bir bakış. (A) AMPA reseptörü ligand bağlanması üzerine yapısal değişimlere maruz kalan bir zar proteinidir. Kapaklı şeklinde ligand-binding etki kırmızı burada daire içine. (B) protein bağlı olmayan AMPA ligand bağlayıcı etki alanı, bir açık konformasyon (sol) olarak bulunmaktadır. Glutamat ligand bağlı olduğunda, protein ligandının (sağ) kapatır. LBD üzerinde ispat bölgelerinde florofor yerleştirilmesiyle, bu konformasyonel değişimin doğası sonra floresan ömrünü etkileyecek flüoroforlar değişiklikleri arasındaki mesafe olarak görülebilir. (Cı) ile etiketlenmesi, bütün hücreler, ilgilenilen protein hem de arka plan zar proteinlerinin her ikisi de etiketlenmesi (sol) meydana gelebilir. Proteaz bölünme sonra, ilgilenilen protein LRET sinyal sağlam bir arka plan sinyali (sağ) bırakarak, optimum olmayan bir fragmanının çözünür bir salınmasına kaybolur. Bu plan sinyal daha sonra ham sinyal düşülür.
Protocol
Representative Results
Discussion
LRET bilim adamları, tek bir proteinin içinde yanı sıra multimer alt birimler arasındaki etki arasındaki mesafeleri ölçmek için olanak sağlayan güçlü bir tekniktir. Bu nedenle, LRET proteinlerden veya diğer makromoleküllerden yapısal değişiklikleri ve dinamiğini incelenmesi için çok uygundur. Yukarıdaki protokol kolayca hipotezlerini test etmek için düzgün donanımlı laboratuvarı izin vermelidir; Ancak, yeni araştırmacının başına bela olabilecek hata birçok ortak kaynakları vardır. Az…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Bu çalışma Sağlık Hibe GM094246, Amerikan Kalp Birliği Hibe 11GRNT7890004 ve Ulusal Bilim Vakfı Hibe MCB-1110501 Ulusal Sağlık Enstitüleri tarafından desteklenmiştir.
Materials
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the ms range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument. | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz Cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir Bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Riferimenti
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochimica. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).

