Afsløring glykogen i perifere mononukleære blodceller med Periodic Acid Schiff Farvning
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
Periodisk syre Schiff (PAS) farvning er en immunhistokemisk teknik, der er meget udbredt i muskel forskning og diagnostik. Det er også anvendes som et diagnostisk redskab på blodprøver. Teknikken virker ved at anvende periodiske syreopløsning til prøven, som oxiderer enheder inden polysaccharid skabe aldehydgrupper, som reagerer med den farveløse Schiffs reagens for derved at frembringe en dyb magenta produkt. Trinene i denne fremgangsmåde er vist i figur 1. Pletten fik noget med polysaccharider magenta, herunder glycogen, glycoproteiner, glycolipider, muciner eller andre molekyler med polysaccharid dele.
PAS-farvning er ofte anvendt til at måle glykogen niveauer i muskelfibre. Muskler vævssnit er ideelle til den teknik, som de fast tillægger dias og modstå flere Vask og farvning trin. Glycogen er mest til stede i hurtige ryk type II muskelfibre, som har en stor efterspørgselfor hurtig ATP-produktion kræver glycogen for maksimal ydelse 1,2. Glycogen er en forgrenet polymer af glucose, der kan opdeles i fri glucose gennem virkningen af glycogenphosphorylaseinhibitorer enzymer. I tider med hvile og ernæringsmæssig tilstrækkelig, er glykogen genopfyldes gennem processen med glycogenese, mens i tider med ernæringsmæssige insufficiens eller højenergi-demand; glykogen er opdelt i glukose ved glycogenolyse. Fra så tidligt som i 1950'erne kliniker forskere har udforsket PAS-farvning på blodprøver for at analysere glykogen indhold i forskellige sygdomme 3-7. For eksempel i Pompes sygdom-en respektabelt glykogen lagring sygdomsspecifikke hvide blodlegemer ophobes store mængder glykogen, der adskiller sig væsentligt fra raske kontroller 8.
Denne video-artiklen viser en tilpasset version af PAS-farvning til brug på perifere mononukleære blodceller (PBMC) Prøver fra venøst blod fra raske forsøgspersoner. PBMCs mest indeholder lymfocytter af T-lymfocyt og B lymfocyt familier, samt andre immunceller såsom naturlige dræberceller og monocytter. Det første oprensningstrin fjerner erytrocytter, neutrofile og andre granulocytter. Denne teknik giver data på en koncentreret del af lymfocytter muliggør mere robust tælling af PAS-positive celler i forhold til at bruge fuldblod udstrygninger.
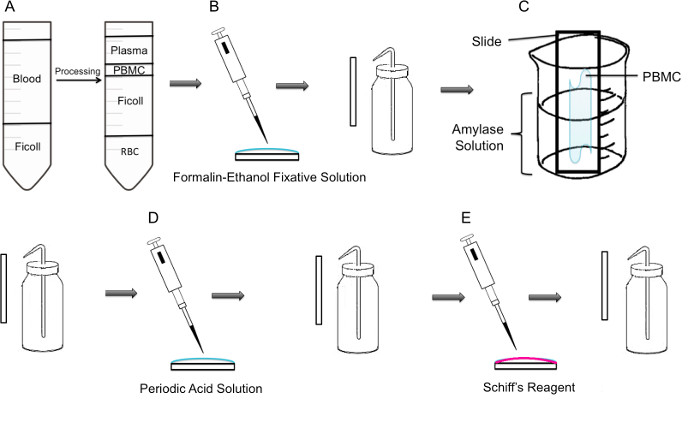
Figur 1:. Trinvis metode PAS farvning på PBMC (A) Først isolering af PBMC opnået gennem ficoll gradient, venstre panel viser fremstillingen før centrifugering, højre panel viser den efter centrifugering, hvor fibrinlaget indeholdende PBMC observeres i centrum af røret. (B) Isolerede PBMC'er er fastgjort på objektglasset ved hjælp af formalin-ethanol fastgørelse Solution. Objektglasset forsigtigt skyllet med destilleret vand fra en plastik vaskeflaske. (C) Objektglasset anbringes derefter i et 100 ml bægerglas halvvejs fyldt med amylaseopløsning, som vil opløse glykogen. Slæden forsigtigt skylles. (D) Slæden behandles med periodisk sur opløsning, hvor oxidation af saccharider finder sted. Objektglassene skylles forsigtigt; dette vil fjerne overskydende periodisk syre og stoppe oxidationstrinnet. (E) Når Schiff-reagens tilsættes til slides, vil det reagere med aldehyder skabt under oxidationstrinnet. Denne farveløse reagens vil derefter resultere i en dyb rød magenta produkt. Objektglassene skylles forsigtigt at fjerne overskydende Schiff-reagens.
Protocol
Representative Results
Discussion
De kritiske trin i denne video artiklen var under vask og amylase behandling af cellerne. Mens vaske dias blev den afgørende skridt ved hjælp af en plastik squeezable vask flaske og lade vandet forsigtigt køre gennem prøven på objektglasset og ikke direkte sigte på prøverne. Selv den mindste direkte vandtryk ville bevirke, at cellerne til at komme væk fra dias. Et andet afgørende skridt var at bruge den samme slide for ± amylase forhold. Efter PBMC'erne blev klæbet til objektglasset blev objektglasset for…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
Riferimenti
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). Biochimica. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

