Oppdager Glykogen i perifere mononukleære blodceller med Periodisk Acid Schiff Farging
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
Perjodsyre Schiff (PAS) farging er en immunhistokjemisk teknikk som er mye brukt i muskel forskning og diagnostikk. Det er også anvendes som et diagnostisk verktøy i blodprøver. Teknikken virker ved å påføre perjodsyre løsning til prøven, som oksiderer enheter i polysakkarid-skaper aldehydgrupper som reagerer med det fargeløse Schiffs reagens for derved å gi en dyp magenta produkt. Trinnene i denne fremgangsmåten er vist i figur 1. Flekken svinger noe med polysakkarider magenta, inkludert glykogen, glykoproteiner, glykolipider, slimstoffer eller andre molekyler med molekyldeler polysakkarid.
PAS-farging blir ofte anvendt for å måle glykogeninnhold i muskel fiber. Muskler vevssnitt er ideelle for den teknikken som de fast feste til raset og tåle flere vask og farging trinn. Glykogen er de til stede i raske rykk Type II muskelfibre, som har en høy etterspørselfor rask ATP produksjon krever glykogen for maksimal ytelse 1,2. Glykogen er en forgrenet polymer av glukose som kan deles opp i fri glukose ved virkningen av glykogen-fosforylase-enzymer. I tider med hvile og næringsforsyning, er glykogen etterfylles gjennom prosessen med glykogenesen, mens i tider med ernæringssvikt eller høy energi etterspørsel; glykogen brytes ned til glukose ved glykogenolyse. Fra så tidlig som i 1950 kliniker forskere har utforsket PAS flekker på blodprøver for å analysere glykogeninnhold i ulike sykdommer 3-7. For eksempel, i Pompes sykdom-en bonafide glykogen lagring sykdoms hvite blodceller akkumulere store mengder glykogen som skiller seg vesentlig fra friske kontroller 8.
Denne video-artikkelen viser en tilpasset versjon av PAS farging for bruk på perifere mononukleære blodceller (PBMC) prøver fra venøs blod av friske mennesker. PBMCs inneholder hovedsakelig lymfocytter av T-lymfocytter og B-lymfocytt-familier, så vel som andre immunceller så som naturlige dreperceller og monocytter. Det første rensetrinn fjernes erytrocytter, nøytrofile granulocytter og andre. Denne teknikken gir data på en konsentrert andel av lymfocytter som åpner for mer robust oppregning av PAS-positive celler sammenlignet med bruk av fullblodflekker.
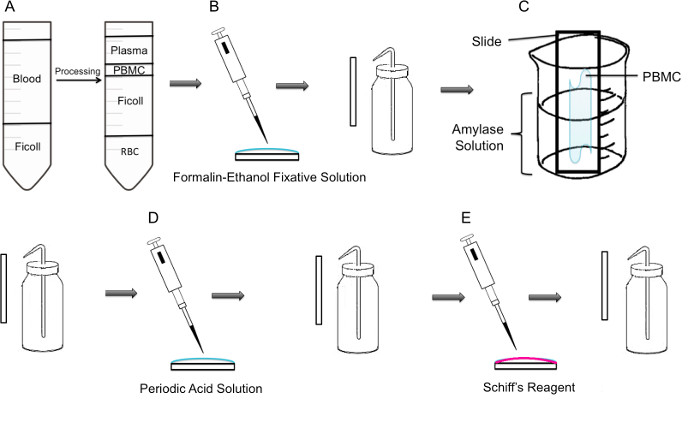
Figur 1:. Steg for steg metodikk av PAS flekker på PBMC (A) Først er isolering av PBMC oppnådd gjennom ficoll gradient, viser venstre panel forberedelse før sentrifugering, viser høyre panel det etter sentrifugering hvor fibrinlagområdet inneholder PBMC er observert i sentrum av røret. (B) Isolerte PBMC-er festet til sleiden ved hjelp av formalin-etanol festing Løsnsjon. Sleiden er forsiktig skylt med destillert vann fra en plast vaskeflaske. (C) Sleiden blir deretter plassert i et 100 ml begerglass halvveis fylt med amylase-oppløsning, noe som vil oppløse glykogen. Raset er forsiktig skylt. (D) Raset behandles med perjodsyre løsning, hvor oksidasjon av sakkarider foregår. Lysbildene er forsiktig skylt; Dette vil fjerne overskudd av perjodsyre og stoppe oksydasjonstrinnet. (E) Ved at Schiff-reagens tilsettes til skinnene, vil det reagere med aldehyder som dannes under oksidasjonstrinnet. Denne fargeløs reagens vil da resultere i en dyp rød magenta produkt. Objektglassene forsiktig skyllet for å fjerne overskudd av Schiffs reagens.
Protocol
Representative Results
Discussion
De kritiske trinnene i denne videoen artikkelen var under vask og amylase behandling av cellene. Mens vasking av glassplatene ble styringstrinnet ved hjelp av en plast sammenklembar vaskeflaske og la vannet forsiktig drevet gjennom prøven på sleiden og ikke sikter direkte på prøvene. Selv den minste direkte vanntrykk ville føre til at cellene til å komme ut av lysbildet. Et annet viktig skritt var å bruke den samme lysbilde for ± amylase forhold. Etter PBMC ble klebet til sleiden, ble objektglasset forsiktig pla…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
Riferimenti
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). Biochimica. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

