La detección de glucógeno en las células mononucleares de sangre periférica con ácido periódico de Schiff tinción
Summary
Periodic acid Schiff staining is a technique that visualizes the polysaccharide content of tissues. This article demonstrates periodic acid Schiff staining protocol adapted for use on peripheral blood mononuclear cells purified from human venous blood. Such samples are enriched for lymphocytes and other white blood cells of the immune system.
Abstract
Periodic acid Schiff (PAS) staining is an immunohistochemical technique used on muscle biopsies and as a diagnostic tool for blood samples. Polysaccharides such as glycogen, glycoproteins, and glycolipids stain bright magenta making it easy to enumerate positive and negative cells within the tissue. In muscle cells PAS staining is used to determine the glycogen content in different types of muscle cells, while in blood cell samples PAS staining has been explored as a diagnostic tool for a variety of conditions. Blood contains a proportion of white blood cells that belong to the immune system. The notion that cells of the immune system possess glycogen and use it as an energy source has not been widely explored. Here, we describe an adapted version of the PAS staining protocol that can be applied on peripheral blood mononuclear immune cells from human venous blood. Small cells with PAS-positive granules and larger cells with diffuse PAS staining were observed. Treatment of samples with amylase abrogates these patterns confirming the specificity of the stain. An alternate technique based on enzymatic digestion confirmed the presence and amount of glycogen in the samples. This protocol is useful for hematologists or immunologists studying polysaccharide content in blood-derived lymphocytes.
Introduction
Ácido periódico de Schiff (PAS) tinción es una técnica inmunohistoquímica que se utiliza ampliamente en la investigación y diagnóstico muscular. También se utiliza como una herramienta de diagnóstico en muestras de sangre. La técnica funciona mediante la aplicación de una solución de ácido periódico a la muestra, que se oxida unidades dentro de los polisacáridos crear grupos aldehído que reaccionan con el reactivo de Schiff la incoloro produciendo de este modo un producto magenta profundo. Los pasos de este procedimiento se muestran en la Figura 1. La mancha resulta nada con polisacáridos magenta, incluyendo glucógeno, glicoproteínas, glicolípidos, mucinas, u otras moléculas con restos de polisacáridos.
Tinción PAS se utiliza a menudo para medir los niveles de glucógeno en las fibras musculares. Secciones de tejido músculos son ideales para la técnica, ya que se adhieren firmemente a la diapositiva y soportan múltiples etapas de lavado y tinción. El glucógeno es más presente en las fibras musculares de contracción rápida de tipo II, que tienen una gran demandapara la producción de ATP rápido que requiere de glucógeno para el máximo rendimiento de 1,2. El glucógeno es un polímero ramificado de glucosa que se puede dividir en glucosa libre a través de la acción de las enzimas de la glucógeno fosforilasa. En tiempos de descanso y nutricional-suficiencia, el glucógeno se repone a través del proceso de glucogénesis, mientras que en los momentos de alta energía o la insuficiencia de la demanda nutricional; se descompone el glucógeno en glucosa por la glucogenólisis. Ya desde la década de 1950 los científicos clínicos han explorado tinción PAS en muestras de sangre para analizar el contenido de glucógeno en diversas enfermedades 7.3. Por ejemplo, en la enfermedad de Pompe, un almacenamiento de glucógeno de buena fe células blancas de la sangre disease- se acumulan grandes cantidades de glucógeno que difiere significativamente de los controles sanos 8.
Este artículo de vídeo demuestra una versión adaptada de la tinción de PAS para su uso en células mononucleares de sangre periférica (PBMC) a partir de muestras de sangre venosa de los sujetos humanos sanos. PBMCs contienen en su mayoría linfocitos de los linfocitos T y las familias de linfocitos B, así como otras células inmunes, tales como células asesinas naturales y monocitos. La primera etapa de purificación elimina los eritrocitos, neutrófilos, granulocitos y otros. Esta técnica proporciona datos sobre una proporción concentrada de linfocitos que permiten para la enumeración más robusta de células PAS positivos en comparación con el uso de enteros frotis de sangre.
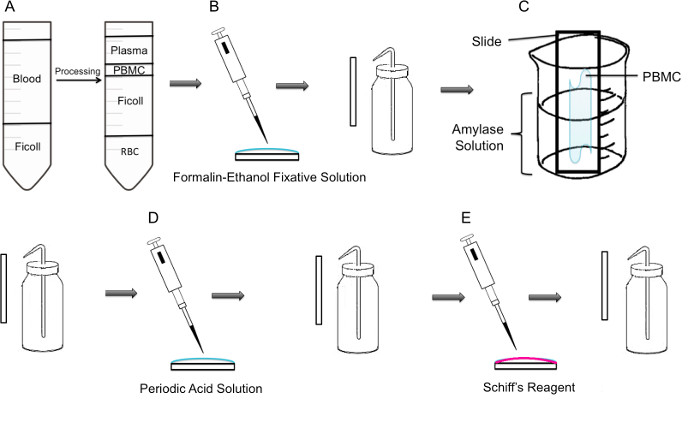
Figura 1:. Paso a paso metodología de la tinción PAS en PBMC (A) En primer lugar, el aislamiento de PBMC se logra mediante gradiente de Ficoll, el panel izquierdo muestra la preparación antes de la centrifugación, el panel derecho muestra que después de la centrifugación, donde la capa leucocitaria que contiene la PBMC se observa en el centro del tubo. (B) PBMCs aisladas se fijan sobre el portaobjetos utilizando Solu la adherencia de formalina-etanolción. El portaobjetos se enjuaga suavemente con agua destilada de una botella de lavado de plástico. (C) El portaobjetos se coloca entonces en un vaso de precipitados de 100 ml a mitad de camino lleno de solución amilasa, que se disolverá glucógeno. El portaobjetos se enjuaga suavemente. (D) El portaobjetos se trató con solución de ácido periódico, donde la oxidación de los sacáridos se lleva a cabo. Los portaobjetos se aclararon de forma abundante; se eliminará el exceso de ácido periódico y detener la etapa de oxidación. (E) Cuando se añade el reactivo de Schiff a las diapositivas, es el que reacciona con aldehídos creados durante la etapa de oxidación. Este reactivo incoloro entonces resultar en un producto rojo magenta profundo. Las diapositivas se enjuagan suavemente para eliminar el exceso de reactivo de Schiff.
Protocol
Representative Results
Discussion
Los pasos críticos de este artículo de vídeo fueron durante el lavado y la amilasa tratamiento de las células. Mientras se lava las diapositivas, el paso clave estaba utilizando una botella de lavado squeezable plástico y dejar que el agua corra suavemente a través de la muestra en la diapositiva y no apuntar directamente contra las muestras. Incluso la más mínima presión de agua directa sería hacer que las células para salir de la diapositiva. Otro paso clave fue utilizar la misma diapositiva durante ± cond…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
This research was supported by a grant from the NSERC Discovery program grant number RGPIN 418522-2013. We thank R. Kilgour for helpful discussions, and Katelin Gresty and Dr. A. Berghdal for providing the mouse muscle sections.
Materials
| Periodic Acid Shiff Kit | Sigma-Aldrich | 395B | Bring to room temperature prior to use. Materials in this kit are toxic and harmful. Use caution http://www.sigmaaldrich.com/catalog/product/sigma/395b?lang=en®ion=CA |
| α-Amylase from porcine pancreas | Sigma-Aldrich | A3176 | http://www.sigmaaldrich.com/catalog/product/sigma/a3176?lang=en®ion=CA |
| Binocular Microscope | Carl Zeiss Microscopy | Axio Lab A0 | |
| Glycogen Assay Kit | Sigma-Aldrich | MAK016 | http://www.sigmaaldrich.com/catalog/product/sigma/mak016?lang=en®ion=CA |
| Ficoll-Paque PLUS | VWR, GE Healthcare | 17-1440-02 | Nonionic synthetic polymer of sucrose https://us.vwr.com/store/catalog/product.jsp?product_id=4779441 |
| Centrifuge | For PBMC isolation, swing buckets were used |
Riferimenti
- Rich, P. R. The molecular machinery of keilin’s respiratory chain. Biochem. Soc. Trans. 31 (Pt 6), 1095-1105 (2003).
- Peter, J. B., Barnard, R. J., Edgerton, V. R., Gillespie, C. A., Stempel, K. E. Metabolic profiles of three fiber types of skeletal muscle in guinea pigs and rabbits). Biochimica. 11 (14), 2627-2633 (1972).
- Jones, R. V., Goffi, G. P., Hutt, M. S. R. Lymphocyte glycogen content in various disease. J. Clin. Pathol. 15 (1), 36-39 (1962).
- Scott, R. B. Glycogen in human peripheral blood leukocytes. I. characteristics of the synthesis and turnover of glycogen in vitro. J. Clin. Invest. 47 (2), 344-352 (1968).
- Fedele, D., et al. positive index of lymphocytes and metabolic control in insulin-treated and type II diabetes mellitus. Diabete Metab. 9 (3), 188-192 (1983).
- Brelińska-Peczalska, R., Mackiewicz, S. Cytochemical studies of peripheral blood granulocytes and lymphocytes in patients with systemic lupus erythematosus. Pol.Med.Sci.Hist.Bull. 15 (2), 231-234 (1976).
- Yunis, A. A., Arimura, G. K. Enzymes of glycogen metabolism in white blood cells. I. glycogen phosphorylase in normal and leukemic human leukocytes. Cancer, Res. 24, 489-492 (1964).
- Hagemans, M. L., et al. PAS-positive lymphocyte vacuoles can be used as diagnostic screening test for pompe disease. J. Inherit. Metab. Dis. 33 (2), 133-139 (2010).
- Totsuka, Y., et al. Physical performance and soleus muscle fiber composition in wild-derived and laboratory inbred mouse strains. 95 (2), 720-727 (2003).
- Murat, J. C., Serfaty, A. Simple enzymatic determination of polysaccharide (glycogen) content of animal tissues. Clin. Chem. 20 (12), 1576-1577 (1974).
- Arrizabalaga, O., Lacerda, H. M., Zubiaga, A. M., Zugaza, J. L. Rac1 protein regulates glycogen phosphorylase activation and controls interleukin (IL)-2-dependent T cell proliferation. J. Biol. Chem. 287 (15), 11878-11890 (2012).
- Pelletier, J., G, J., Mazure, N. M. Biochemical titration of glycogen in vitro. J.Vis.Exp. (81), (2013).
- Roach, P. J., Depaoli-Roach, A. A., Hurley, T. D. Tagliabracci V.S. Glycogen and its metabolism: Some new developments and old themes. Biochem.J. 441 (3), 763-787 (2012).
- Salmoral, E. M., Tolmasky, D. S., Krisman, C. R. Evidence for the presence of glycogen in rat thymus. Cell Mol.Biol. 36 (2), 163-174 (1990).
- Darlington, P. J., et al. Diminished Th17 (not Th1) responses underlie multiple sclerosis disease abrogation after hematopoietic stem cell transplantation. Ann.Neurol. 73 (3), 341-354 (2013).

