A-crítico tamaño femoral Defecto sencillo modelo en ratones
Summary
Animal models are frequently employed to mimic serious bone injury in biomedical research. Due to their small size, establishment of stabilized bone lesions in mice are beyond the capabilities of most research groups. Herein, we describe a simple method for establishing and analyzing experimental femoral defects in mice.
Abstract
While bone has a remarkable capacity for regeneration, serious bone trauma often results in damage that does not properly heal. In fact, one tenth of all limb bone fractures fail to heal completely due to the extent of the trauma, disease, or age of the patient. Our ability to improve bone regenerative strategies is critically dependent on the ability to mimic serious bone trauma in test animals, but the generation and stabilization of large bone lesions is technically challenging. In most cases, serious long bone trauma is mimicked experimentally by establishing a defect that will not naturally heal. This is achieved by complete removal of a bone segment that is larger than 1.5 times the diameter of the bone cross-section. The bone is then stabilized with a metal implant to maintain proper orientation of the fracture edges and allow for mobility.
Due to their small size and the fragility of their long bones, establishment of such lesions in mice are beyond the capabilities of most research groups. As such, long bone defect models are confined to rats and larger animals. Nevertheless, mice afford significant research advantages in that they can be genetically modified and bred as immune-compromised strains that do not reject human cells and tissue.
Herein, we demonstrate a technique that facilitates the generation of a segmental defect in mouse femora using standard laboratory and veterinary equipment. With practice, fabrication of the fixation device and surgical implantation is feasible for the majority of trained veterinarians and animal research personnel. Using example data, we also provide methodologies for the quantitative analysis of bone healing for the model.
Introduction
Se estima que la mitad de la población de Estados Unidos experimenta una fractura por la edad de 65 años 1. Para los pacientes con fracturas tratadas quirúrgicamente, 500.000 procedimientos implican el uso de un injerto de hueso 2 y se espera que esta cifra aumente con una población cada vez más envejecida 3 . Aunque el hueso es uno de los pocos órganos que tiene la capacidad para sanar completamente sin dejar cicatriz, hay casos en que el proceso falla 3,4. Dependiendo de las circunstancias y la calidad del tratamiento, 30.2% de las fracturas de huesos largos fallar, lo que resulta en la no unión 3,5. Si bien sigue habiendo cierto debate sobre la definición, pseudoartrosis, lesiones óseas críticos de tamaño o no sindicalizados generalmente se refiere a una lesión que no sana durante toda la vida natural de la materia 6. Para fines experimentales, esta duración se acorta el tiempo promedio requerido para la curación completa de una lesión de tamaño medio hueso. Lesiones óseas no sindicalizados se producen por numrazones erous, pero los principales factores incluyen trauma extremo que resulta en una brecha crítica de tamaño, infección, mala angiogénesis, el consumo de tabaco, o la capacidad de regeneración ósea inhibida debido a la enfermedad o la edad de 7 años. Incluso si no uniones son tratados con éxito, puede costar más de $ 60,000 por procedimiento, dependiendo del tipo de lesión y los enfoques utilizados 8.
En casos moderados, se emplea un injerto óseo autólogo. Esta estrategia implica la recuperación del hueso de un sitio donante y la implantación en el sitio de la lesión. Si bien este enfoque es extremadamente eficaz, el volumen de hueso derivado del donante disponible es limitada y el procedimiento implica una cirugía adicional, que se traduce en dolor persistente en muchos pacientes 9,10. Además, la eficacia del injerto de hueso autólogo es dependiente de la salud del paciente. Los sustitutos óseos fabricados con materiales sintéticos o hueso de cadáver procesados son abundantemente disponibles 11-13, pero HÃve limitaciones significativas, incluyendo las propiedades pobres de adhesión de la célula huésped, la reducción de osteoconductividad, y el potencial para el rechazo inmune 14. Por tanto, existe una necesidad urgente de tecnologías de regeneración ósea que son seguros, eficaces y ampliamente disponibles.
Nuestra capacidad para mejorar las estrategias de regeneración de hueso depende fundamentalmente de la capacidad de imitar traumatismo óseo grave en animales de laboratorio, pero la generación y la estabilización de las lesiones óseas grandes es técnicamente difícil. En la mayoría de los casos, grave trauma hueso largo es imitado experimentalmente mediante el establecimiento de un defecto que no se cura de forma natural. Aunque puede variar con la especie 15, esto se logra mediante la eliminación completa de un segmento de hueso que es mayor que 1,5 veces el diámetro de la sección transversal del hueso 16. El hueso se estabiliza luego con un implante metálico para mantener la orientación correcta de los bordes de la fractura y permitir la movilidad. Debido a su pequeño tamaño y la fragilidad desus huesos largos, el establecimiento de este tipo de lesiones en los ratones están más allá de las capacidades de la mayoría de los grupos de investigación. Como tal, los modelos de defectos de huesos largos se limitan a ratas y animales más grandes. Sin embargo, los ratones ofrecen ventajas significativas en investigación que pueden ser modificados y criados como cepas inmunocomprometidos que no rechazan las células y tejidos humanos genéticamente.
Para las aplicaciones basadas en células humanas, los ratones inmunodeprimidos son atractivas para trabajar con ellos porque son fisiológicamente bien caracterizados, fácil de casa, rentables y de fácil analizaron radiográfica como microscópicamente. De suma importancia es que los ratones inmunodeprimidos no rechazan las células de diferentes especies, incluyendo los seres humanos. Su pequeño tamaño también permite el ensayo de un número muy pequeño de células o volúmenes de andamios experimentales en aplicaciones ortopédicas. Se han descrito varios modelos murinos ortopédicos que permitirse diversos grados de estabilidad ósea 17,18. Aquellos systems que resultan en niveles muy altos de estabilidad, tales como fijadores externos y las placas de bloqueo se curan predominantemente por la osificación endocondral intramembranous aunque la curación ha sido reportado 19. Por el contrario, las que permiten algunos micro y / o macro-movimiento, como las que emplean pasadores medulares no fijadas o parcialmente fijos, por lo general se curan con un predominio de la osificación endocondral 20,21. Unión retardada o defectos no sindicalizados de los huesos largos son particularmente difíciles de lograr en los ratones debido al nivel adicional de estabilización requerida. Sin embargo, se ha informado de una serie de enfoques, incluyendo pasadores medulares con clavos entrelazados, placas de bloqueo y fijadores externos 22. Estos sistemas generalmente funcionan bien, pero teniendo en cuenta su diseño complicado que puede ser técnicamente difícil de instalar. Por ejemplo, García et al. 23 ideó un sistema de pasador de enclavamiento elegante para su uso en ratones, pero el procedimiento implica incisiones en dos sitios separadoss y una amplia modificación del fémur para acomodar los pasadores. Estos procedimientos se realizaron bajo un microscopio de disección.
En este documento, se describe un sencillo pasador medular femoral con un collar central diseñado para evitar el cierre de un déficit óseo 3 mm y también delinear los bordes originales del defecto. Mientras que el pasador no se fija en el hueso, el tamaño preciso de pasador y el diámetro de escariado de los resultados cavidad medular en la interferencia suficiente para minimizar el movimiento de torsión (Figura 1). Con una cuidadosa selección de edad endogámica, género y ratones de la cepa emparejados, el resultado es un no-uniondefect hipertrófica altamente reproducible 22 que puede ser fácilmente evaluada radiológicamente. Además regiones de interés pueden ser definidos de forma reproducible después de micro-tomografía computarizada (μCT) para la medición de la formación de hueso de novo y los parámetros histomorphological. Los pasadores se prototipos en nuestro laboratorio utilizando herramientas disponibles.
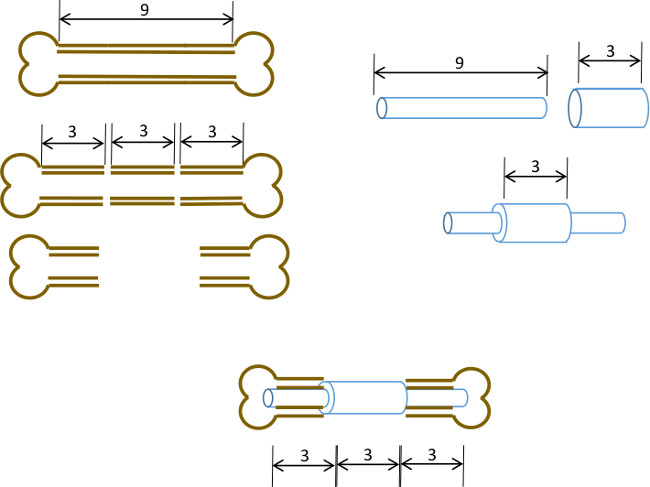
Figura 1: Principio Experimental resumen esquemática del modelo de defecto segmentario.. El segmento central 3 mm de un fémur murino 9-10 mm se extirpa quirúrgicamente (izquierda). Un tubo de acero quirúrgico de calibre 19 de 3 mm de largo se pasa más de un 9 mm de largo, 22 G tubo de acero inoxidable y se fija con adhesivo en el centro exacto (derecha). El pasador resultante se encaja en los canales medulares de las porciones proximal y distal restantes del fémur con el collar 19 G sustituyendo el segmento de 3 mm de hueso (por debajo de, centro).
Protocol
Representative Results
Discussion
En este documento, se describe un método simple para generar un defecto crítico tamaño pin-estabilizada del fémur murino utilizando estándar de laboratorio y equipo veterinario. Mientras que el montaje de los pasadores y el procedimiento quirúrgico en sí mismo requiere práctica, está dentro de las capacidades de un científico de investigación biomédica bien entrenado o veterinario.
El pasador se coloca en el canal medular sin fijación adicional, haciendo que el procedimiento té…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Damos las gracias al personal y los veterinarios en el Departamento de Medicina Comparada, Temple, Texas Scott & White Hospital, por su asesoramiento y ayuda inestimable durante el desarrollo de esta técnica. Este trabajo fue financiado en parte por el Instituto de Medicina Regenerativa de fondos del programa, Scott & White RGP subvención # 90172, NIH 2P40RR017447-07 y NIH R01AR066033-01 (NIAMS). Se agradece al Dr. Suzanne Zeitouni para las pruebas del manuscrito.
Materials
| Name of Equipment/Material* | Company | Catalog or model | Notes |
| Pin Assembly | |||
| Dremel rotary tool | Dremel | 8220 | or equivalent |
| Heavy duty cut off wheel | Dremel | 420 | |
| Surgical tubing 19G | Small Parts (Amazon) | B000FMZ8LY | OD 1.07mm, ID 0.889mm |
| Surgical tubing 21G | Small Parts (Amazon) | B000FMZ8YQ | OD 0.82mm, ID 0.635mm |
| Surgical tubing 22G | Small Parts (Amazon) | B000FMYLZS | OD 0.719mm, ID 0.502mm |
| Surgical tubing 23G | Small Parts (Amazon) | B000FN0SY0 | OD 0.643mm, ID 0.444mm |
| Cyanoacrylate adhesive | Loctite | 1365882 | |
| Emery disc | Dremel | 413 | |
| Rubber polishing point | Dremel | 462 | |
| Felt polishing disc | Dremel | 414 | |
| Gelatin sponge | Surgifoam/Ethicon | 1974 | |
| Punch biopsy cutter | Miltex | 33-34 | |
| Surgery/post-operative | |||
| Warm pad and circulator pump | Stryker/Thermocare | TP700, TP700C, TPP722 | |
| Coverage quaternary spray | Steris | 1429-77 | |
| Bead sterilizer | Germinator/CellPoint Scentific | Germinator 500 | |
| Anesthesia system | VetEquip Inc | 901806 or 901807/901809 | |
| Isofluorane anesthetic | VETone/MWI | 501017, 502017 | |
| Surgical disinfectant | Chloraprep/CareFusion | 260449 | |
| Surgical tools | Fine Science Tools | various | recommend German made |
| Face protection | Splash Shield | 4505 | |
| Rechargable high speed drill | Fine Science Tools | 18000-17 | |
| Diamond cutting wheel | Strauss Diaiond | 361.514.080HP | |
| Absorbable sutures | Covidien | UM-213 | |
| Outer sutures | Ethicon | 668G | or equivalent |
| Vetbond | 3M | 1469SB | or equivalent |
| Hydration gel | Clear H2O | 70-01-1082 | |
| Diet gel | Clear H2O | 72-01-1062 | |
| Buprenorphine | Reckitt and Benckser | 12496-0757-01 | controlled substance |
| Mouse igloos | Bio Serv | K3328, 3570,3327 | |
| Euthanasia cocktail | Euthasol/Virbac | 710101 | controlled substance |
| Analysis | |||
| Live animal imager | Orthoscan | FD Pulse | or equivalent |
| Micro-CT unit and software | Bruker | Skyscan1174 | or equivalent |
| Sealing film/Parafilm M | VWR or Fisher | 100501-338, S37441 | |
| *Generic sources are suitable for all other items such as gause, drapes, protective clothing, animal care equipment. | |||
Riferimenti
- Brinker, M. R., O’Connor, D. P. The incidence of fractures and dislocations referred for orthopaedic services in a capitated population. J Bone Joint Surg Am. 86, 290-297 (2004).
- Cheung, C. The future of bone healing. Clin Podiatr Med Surg. 22, 631-641 (2005).
- Rosemont, I. L. . United States Bone and Joint Decade: The burden of musculoskeletal diseases and musculoskeletal injuries. , (2008).
- Tzioupis, C., Giannoudis, P. V. Prevalence of long-bone non-unions. Injury. 38, S3-S9 (2007).
- Marsh, D. Concepts of fracture union, delayed union, and nonunion. Clin Orthop Relat Res. , S22-S30 (1998).
- Spicer, P. P., et al. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 7, 1918-1929 (2012).
- Green, E., Lubahn, J. D., Evans, J. Risk factors, treatment, and outcomes associated with nonunion of the midshaft humerus fracture. J Surg Orthop Adv. 14, 64-72 (2005).
- Kanakaris, N. K., Giannoudis, P. V. The health economics of the treatment of long-bone non-unions. Injury. 38, S77-S84 (2007).
- Dimitriou, R., Mataliotakis, G. I., Angoules, A. G., Kanakaris, N. K., Giannoudis, P. V. Complications following autologous bone graft harvesting from the iliac crest and using the RIA: a systematic review. Injury. 42, S3-S15 (2011).
- Boer, H. H. The history of bone grafts. Clin Orthop Relat Res. , 292-298 (1988).
- Aro, H. T., Aho, A. J. Clinical use of bone allografts. Ann Med. 25, 403-412 (1993).
- Burstein, F. D. Bone substitutes. Cleft Palate Craniofac. J. 37, 1-4 (2000).
- Kao, S. T., Scott, D. D. A review of bone substitutes. Oral Maxillofac Surg Clin North Am. 19, 513-521 (2007).
- Boden, S. D. Overview of the biology of lumbar spine fusion and principles for selecting a bone graft substitute. Spine. (Phila Pa 1976). 27, S26-S31 (1976).
- Hollinger, J. O., Kleinschmidt, J. C. The critical size defect as an experimental model to test bone repair materials). J Craniofac Surg. 1, 60-68 (1990).
- Key, J. The effect of local calcium depot on osteogenesis and healing of fractures. J. Bone Joint Surg. (Am). 16, 176-184 (1934).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration). J Orthop Trauma. 23, S31-S38 (2009).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49, 591-599 (2011).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J Orthop Res. 21, 685-690 (2003).
- Hiltunen, A., Vuorio, E., Aro, H. T. A standardized experimental fracture in the mouse tibia. J Orthop Res. 11, 305-312 (1993).
- Manigrasso, M. B., O’Connor, J. P. Characterization of a closed femur fracture model in mice. J Orthop Trauma. 18, 687-695 (2004).
- Garcia, P., et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review. Eur Cell Mater. 26, 1-12 (2013).
- Garcia, P., et al. Development of a reliable non-union model in mice. J Surg Res. 147, 84-91 (2008).
- Flecknell, P. A. The relief of pain in laboratory animals. Lab Anim. 18, 147-160 (1984).
- . . Guidelines on the Euthanasia of Animals. , (2013).
- Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50, 1357-1367 (2012).
- Bagi, C. M., et al. The use of micro-CT to evaluate cortical bone geometry and strength in nude rats: correlation with mechanical testing, pQCT and DXA. Bone. 38, 136-144 (2006).
- Hadjiargyrou, M., et al. Transcriptional profiling of bone regeneration. Insight into the molecular complexity of wound repair. J Biol Chem. 277, 30177-30182 (2002).
- Clough, B. H., et al. Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins. J Bone Miner Res. , (2014).
- Lu, C., et al. Cellular basis for age-related changes in fracture repair. J Orthop Res. 23, 1300-1307 (2005).
- Jepsen, K. J., et al. Genetic variation in the patterns of skeletal progenitor cell differentiation and progression during endochondral bone formation affects the rate of fracture healing. J Bone Miner Res. 23, 1204-1216 (2008).
- Thayer, T. C., Wilson, S. B., Mathews, C. E. Use of nonobese diabetic mice to understand human type 1 diabetes. Endocrinol Metab Clin North Am. 39, 541-561 (2010).
- Jee, W. S., Yao, W. Overview: animal models of osteopenia and osteoporosis. J Musculoskelet Neuronal Interact. 1, 193-207 (2001).

