الجينات ترنسفكأيشن نحو خلايا كروي على لوحات Micropatterned الثقافة لالمعدلة وراثيا زرع الخلايا
Summary
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Abstract
لتحسين فعالية العلاجية لزرع الخلايا، وقد تم تطوير نظام زرع المعدلة وراثيا، الكروية عن طريق الحقن. يتم إعداد الكروية خلية في نظام الثقافة على لوحات micropatterned المغلفة مع البوليمر للحرارة. يتم تشكيل عدد من الكروية على لوحات، والمقابلة لمناطق التصاق الخلية من 100 ميكرون قطر التي تصطف بانتظام بطريقة ثنائية الأبعاد التي تحيط بها مناطق غير لاصقة التي المغلفة من قبل غليكول البولي ايثيلين (PEG) المصفوفة. الأجسام الشبه الكروية يمكن استردادها بسهولة كما وقف السائل عن طريق خفض درجة حرارة لوحات، وكذلك صيانة بنيتها عن طريق تمرير من خلال إبر الحقن من عيار كبير بما فيه الكفاية (أكثر من 27 G). ويتحقق التعديل الوراثي قبل ترنسفكأيشن الجينات باستخدام الناقل الأصلي غير الفيروسية الجين، nanomicelle polyplex، وهو قادر على إدخال الجينات إلى الخلايا دون تعطيل هيكل كروي. لمتزمتالكروية الكبدية آرى مع transfected الجين، معربا عن luciferase المراسل، يتم الحصول على luciferase المراسل مستدام في الحيوانات المزروعة، جنبا إلى جنب مع الحفاظ على وظيفة خلايا الكبد، كما يتضح من التعبير الألبومين. هذا النظام يمكن تطبيقها على مجموعة متنوعة من أنواع الخلايا بما في ذلك خلايا الجذعية الوسيطة.
Introduction
وقد اجتذب العلاج زرع الخلايا باهتمام واسع لعلاج العديد من الأمراض المستعصية. النشاط ونصف العمر من العوامل الحيوية النشطة التي تفرزها الخلايا المزروعة ضرورية لتحسين الفعالية العلاجية للنظام زرع الخلايا. التعديل الوراثي للخلايا قبل الزرع هو تقنية مفيدة لتنظيم والتلاعب الوظائف الخلوية، بما في ذلك إفراز العوامل النشطة بيولوجيا. ومن المهم أيضا للحفاظ على المكروية مواتية للخلايا لتجنب موت الخلايا أو فقدان نشاط الخلايا. ثلاثي الأبعاد الثقافة (3D) خلية كروي، والتي الخلية الى خلية التفاعلات يتم الحفاظ عليها بشكل جيد، واعد لهذا الغرض، على سبيل المثال، لتحسين إفراز الزلال من خلايا الكبد الأولية وتعزيز متعددة النسب تمايز من الخلايا الجذعية الوسيطة (اللجان الدائمة ) 1-7.
في هذه الدراسة، وهو نظام تركيبة جديدة من spheroiيستخدم الثقافة د وترنسفكأيشن الجينات لتكون بمثابة منصة لزرع الخلايا المعدلة وراثيا. لخلق خلايا كروي، يتم استخدام نظام الثقافة كروي على لوحات ثقافة micropatterned. في هذه اللوحات، والمحتشدة المناطق التصاق الخلية من 100 ميكرون قطر بانتظام بطريقة ثنائية الأبعاد، وتحيط بها مناطق غير لاصقة المغلفة من قبل مصفوفة PEG 3. قبل البذر وجود عدد كاف من الخلايا، وتشكل صفائف الكروية 3D من 100 ميكرون في القطر المقابلة للسرير الثقافة micropatterned.
واستعاد الكروية دون تعطيل هيكلها 3D باستخدام حساس للحرارة لوحات لزراعة الخلايا، التي تم المغلفة مع البوليمر للحرارة، وبولي (ISO-propylacrylamide) (PIPAAm) 10/08. هي التي شيدت بنية micropatterned على لوحات للحرارة (مبنية خصيصا). ببساطة عن طريق خفض درجة حرارة لوحات، ويتم فصل الكروية من السرير الثقافة وتفريقد في الفوسفات مخزنة المالحة (PBS). وبالتالي، يمكن الحصول على عدد كبير من الأجسام الشبه الكروية مع حجم موحد من 100 ميكرون في شكل تعليق عن طريق الحقن.
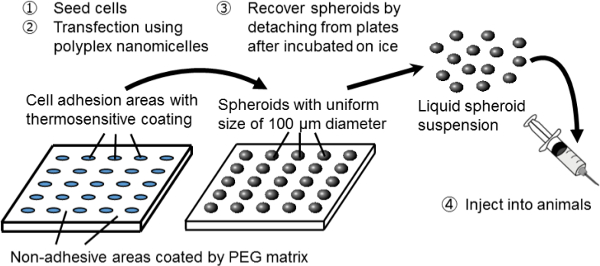
الشكل 1. تمثيل تخطيطي للنظام الثقافة كروي على طبق من ذهب micropatterned. ويتحقق التعديل الوراثي قبل ترنسفكأيشن الجينات باستخدام الناقل الجيني غير الفيروسي الأصلي، nanomicelle polyplex. وهو يتألف من البلازميد الحمض النووي (PDNA) والبولي ايثيلين جلايكول (PEG) بوليمرات كتلة -polycation 11. هذه لديها بنية الأساسية قذيفة مميزة تتكون من قذيفة PEG والنواة الداخلية للPDNA المكثف، مما يسمح آمنة وفعالة إدخال الجينات إلى داخل الخلايا لأغراض علاجية (11). يرجى النقر هنا لمشاهدة نسخة أكبر من ثيالصورة الرقم.
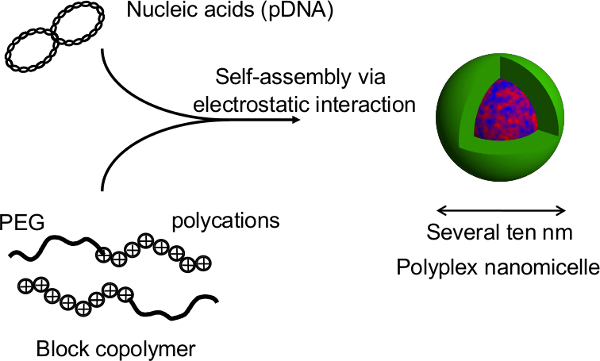
الشكل 2. هيكل nanomicelle polyplex التي شكلتها مجمع الأحماض النووية وبوليمرات كتلة PEG-كتلة polycation. في هذه الدراسة، والميزة الرئيسية لهذه التقنية هي أن هيكل كروي لا تتعطل خلال ترنسفكأيشن الجينات التي nanomicelles. بعد transfections بوساطة nanomicelle من الفئران الكروية الكبدية الأولية، ويتم الحصول على فترات طويلة التعبير التحوير لأكثر من شهر مع إفراز الزلال المستمر من خلايا الكبد في مستوى مماثل لتلك التي الكروية untransfected 12. يتم الاحتفاظ أيضا التعبير التحوير وإفراز الزلال من الكروية بعد الشفاء من لوحات للحرارة. ومن الواضح أن nanomicelles يمكن أن تسهل بأمان إدخال الجين دون أن ينال من وظائف الفطرية من التهاب الكبدatocytes. وبالتالي، فإن الجمع بين خلايا كروي مثقف على لوحات micropatterned للحرارة مع إدخال الجينات باستخدام nanomicelles هو منصة واعدة لزرع الخلايا المعدلة وراثيا. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
في هذا البروتوكول، فمن الأهمية بمكان للحفاظ على هيكل 3D من الكروية خلال خطوات إدخال الجينات والانتعاش كروي. فمن الضروري للحفاظ على microenvironments مواتية للخلايا لتجنب موت الخلايا أو فقدان نشاط الخلايا. على سبيل المثال، إفراز الألبومين، وهي وظيفة الفطرية التمثيلية لخلايا …
Disclosures
The authors have nothing to disclose.
Acknowledgements
نحن نقدر بعمق الدكتور تاكيشي Ikeya والموظفين التقنيين في شركة تويو جوسي، طوكيو، اليابان لتقديم لوحات ثقافة micropatterned للحرارة فضلا عن تقديم المشورة العلمية. كما نشكر السيدة ساتومي اوغورا، السيدة ساي سوزوكي، السيدة اسوكا ميوشي والسيدة Katsue Morii للمساعدة التقنية مع التجارب على الحيوانات. وأيد هذا العمل ماليا في جزء من JSPS KAKENHI غرانت في والمعونة من أجل البحث العلمي، ومركز الابتكار (هيئة النزاهة) برنامج وبرنامج الابتكار S- من وكالة العلوم والتكنولوجيا اليابان (JST)، وJSPS الحدقة إلى النواة البرنامج، A. شبكات البحوث المتقدمة.
Materials
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| collagenase | Wako Pure Chemical Industries | 639-00951 | |
| trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
References
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).

