Gene Transfektion mod sfæroidpartikler celler på mikromønstrede dyrkningsplader for Genetisk modificerede Cell Transplantation
Summary
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Abstract
For at forbedre den terapeutiske effektivitet celle transplantation blev en transplantation-system af genetisk modificerede, injicerbare sphæroider udvikles. Celle sfæroider fremstilles i et dyrkningssystem på mikromønstrede plader belagt med en varmefølsom polymer. Dannes en række sfæroider på pladerne, der svarer til de celleadhæsion områder af 100 um diameter, som jævnligt array i en todimensional måde, omgivet af ikke-klæbende områder, der er belagt med en polyethylenglycol (PEG) matrix. Sfæroiderne kan let udvindes som en flydende suspension ved at sænke temperaturen af pladerne, og deres struktur er godt vedligeholdt ved at lede dem gennem injektionsnåle med en tilstrækkelig stor kaliber (over 27 G). Genetisk modifikation opnås ved gentransfektion bruge den oprindelige ikke-virale gen bærer, Polyplex nanomicelle, som er i stand til at indføre gener i celler uden at forstyrre klumpformet struktur. For pændære hepatocyt sfæroider transficeret med en luciferase-udtrykkende gen, er luciferasen bæredygtigt opnået i transplanterede dyr, sammen med konserverede hepatocyt-funktion, som angivet ved albumin-ekspression. Dette system kan anvendes til en række forskellige celletyper, herunder mesenkymale stamceller.
Introduction
Celle transplantation terapi har tiltrukket stor opmærksomhed til behandling af forskellige genstridige sygdomme. Aktiviteten og halveringstiden af bioaktive faktorer, der udskilles af de transplanterede celler er afgørende for forbedret terapeutisk effektivitet af en celle transplantation system. Genetisk modifikation af cellerne forud for transplantation er en gavnlig teknik til at regulere og manipulere cellulære funktioner, herunder udskillelsen af de bioaktive faktorer. Det er også vigtigt at opretholde en gunstig mikromiljø for cellerne til at undgå celledød eller tab af celleaktivitet. Tredimensionale (3D) klumpformet cellekultur, hvori celle-til-celle-interaktioner er velbevarede, er lovende til dette formål, for eksempel til forbedring albuminsekretion fra primære hepatocytter og fremme multi-slægt differentiering af mesenchymale stamceller (MSC'er ) 1-7.
I denne undersøgelse en ny kombination system spheroid kultur og gen transfektion bruges til at tjene som en platform for genetisk modificeret celle transplantation. Til oprettelse sfæroide celler, er en sfæroid dyrkningssystem på mikromønstrede dyrkningsplader anvendes. På disse plader er celleadhæsion områder af 100 um diameter regelmæssigt opstillet i et todimensionalt måde og er omgivet af ikke-klæbende områder belagt med en PEG-matrix 3. Ved podning et tilstrækkeligt antal celler, er arrays af 3D sfæroider af 100 um i diameter dannet svarende til den mikromønstrede kultur sengen.
Sfæroiderne udvindes uden at forstyrre deres 3D-struktur ved hjælp af varmefølsom celle-dyrkningsplader, der blev overtrukket med en varmefølsom polymer, poly (iso-propylacrylamid) (PIPAAm) 8-10. Den mikromønstrede arkitektur er opbygget på termosensitive plader (specialbyggede). Ved blot at sænke temperaturen af pladerne er de sfæroider løsrevet fra kulturen seng og dispergered i phosphatbufret saltvand (PBS). Således kan et stort antal sfæroider med en ensartet størrelse på 100 um opnås i form af en injicerbar suspension.
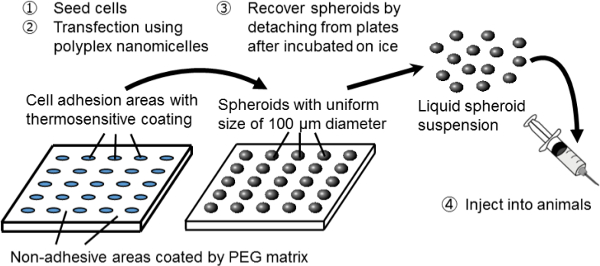
Figur 1. Skematisk repræsentation af klumpformet dyrkningssystem på en mikromønstrede plade. Genetisk modifikation opnås ved gentransfektion bruge den oprindelige ikke-virale gen bærer, Polyplex nanomicelle. Det består af plasmid-DNA (pDNA) og polyethylenglycol (PEG) -polycation blokcopolymerer 11. Disse har en karakteristisk kerne-shell struktur, der består af en PEG skal og en indre kerne af kondenseret pDNA, så introduktion sikker og effektiv gen i celler til terapeutiske formål 11. Klik her for at se en større version af this figur.
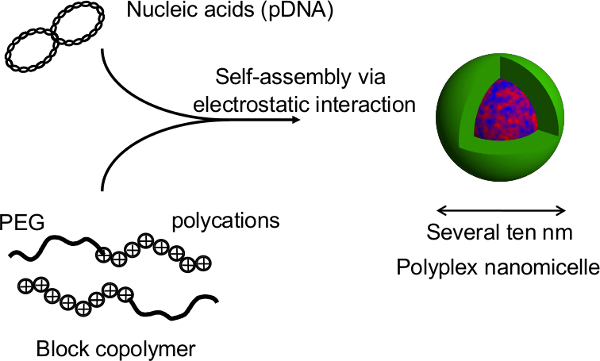
Figur 2. Struktur af Polyplex nanomicelle dannet ved kompleks af nukleinsyrer og PEG-blok-polykation blokcopolymerer. I denne undersøgelse er den primære fordel ved denne teknik er, at klumpformet struktur ikke ødelægges under gentransfektion af nanomicelles. Efter nanomicelle-medierede transfektioner af rotte primære hepatocyt sfæroider, forlænges transgenekspression opnået for mere end en måned med kontinuerlig albuminsekretion fra hepatocytter på et niveau, der kan sammenlignes med ikke-transficerede sfæroider 12. Den transgen ekspression og albumin udskillelse fra spheroids er også opretholdt efter helbredelse fra varmefølsomme plader. Det er klart, nanomicelles trygt kan lette genindførsel uden at svække de medfødte funktioner hepatocytes. Kombinationen af kugleformede celler dyrket på termosensitive mikromønstrede plader med gen-introduktion hjælp nanomicelles er en lovende platform for genetisk modificerede celle transplantation. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
I denne protokol, er det afgørende at opretholde 3D-strukturen af sfæroider under trinnene genindførsel og klumpformet nyttiggørelse. Det er vigtigt at opretholde en gunstig mikromiljøer for cellerne at undgå celledød eller tab af celleaktivitet. For eksempel albumin sekretion, en repræsentativ medfødte funktion af hepatocytter, er velbevaret i hepatocyt sfæroider, mens hepatocytterne i den konventionelle monolayerkultur hurtigt mister deres sekretorisk kapacitet få dage efter podning 12. For…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi dybt værdsætter Dr. Takeshi Ikeya og teknisk personale i Toyo Gosei, Tokyo, Japan for at give varmefølsom mikromønstrede dyrkningsplader samt videnskabelig rådgivning. Vi takker også Ms. Satomi Ogura, Ms Sae Suzuki, Ms. Asuka Miyoshi og Ms. Katsue Morii til teknisk bistand med dyreforsøg. Dette arbejde blev støttet delvist af JSP'er KAKENHI Grant-in-Støtte til videnskabelig forskning, Center for Innovation (COI) Program og S- innovationsprogram fra Japan Science and Technology Agency (JST) og JSP'er kerne- til-Core Program, A. Advanced Research Networks.
Materials
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| collagenase | Wako Pure Chemical Industries | 639-00951 | |
| trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
References
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).

