遺伝的に改変された細胞移植のためのマイクロパターン培養プレート上スフェロイド細胞に対する遺伝子導入
Summary
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Abstract
細胞移植の治療効果を改善するために、遺伝的に改変された、注射可能なスフェロイドの移植システムを開発しました。細胞スフェロイドは、感熱性ポリマーでコーティングされたマイクロパターン上でプレート培養系で調製されます。スフェロイドの数は、ポリエチレングリコール(PEG)マトリックスによって被覆されている非接着性領域によって囲まれ、定期的に二次元的に配列された直径100μmの細胞接着領域に対応する、プレート上に形成されています。スフェロイドは、容易にプレートの温度を低下させることにより液体懸濁液として回収することができ、その構造は、ウェル(27 G上の)十分に大きな口径の注射針に通して維持されます。遺伝子改変は、球状構造を破壊することなく細胞に遺伝子を導入することが可能である元の非ウイルス遺伝子キャリア、ポリプレックスナノミセルを用いた遺伝子導入によって達成されます。プリムのためのアルブミンの発現によって示されるように、ルシフェラーゼを発現する遺伝子でトランスフェクト進肝細胞スフェロイドは、ルシフェラーゼは持続、保存肝細胞機能と共に、移植動物において得られます。このシステムは、間葉系幹細胞を含む種々の細胞型に適用することができます。
Introduction
細胞移植療法は、様々な難治性疾患を治療するために広く注目を集めています。移植された細胞によって分泌される生物活性因子の活性及び半減期は、細胞移植システムの改良された治療効果のために不可欠です。移植前の細胞の遺伝子改変は、生物活性因子の分泌などの細胞機能を調節して操作するための有益な技術です。これは、細胞死または細胞活性の喪失を回避するための細胞のための良好な微環境を維持することも重要です。細胞間相互作用が十分に保持された3次元(3D)スフェロイド細胞培養物は、(初代肝細胞のアルブミン分泌を改善し、間葉系幹細胞の多系列分化を促進するために、例えば、この目的のためにMSCを約束しています)1-7。
spheroiのこの研究では、新規な組み合わせシステムD培養および遺伝子トランスフェクションは、遺伝的に改変された細胞移植のためのプラットフォームとして機能するように使用されます。スフェロイド細胞を作成するための、マイクロパターン培養プレート上でスフェロイド培養系を用いています。これらのプレート上で、100ミクロン直径の細胞接着領域が規則的に二次元的に配列され、PEGマトリックス3によって被覆された非接着性領域によって囲まれています。細胞の十分な数を播種することにより、直径100μmの3Dスフェロイドのアレイは、マイクロパターン培養ベッドに対応して形成されています。
スフェロイドは、感熱性細胞培養プレートを使用して、3D構造を破壊せずに回収される感熱性ポリマー、ポリ(イソ-プロピル)(PIPAAm)8-10でコーティングしたもの。マイクロパターンアーキテクチャは、感熱板(カスタムビルド)上に構築されています。単にプレートの温度を下げることにより、スフェロイド培養ベッドから離脱して分散されていますリン酸中のdは、緩衝生理食塩水(PBS)。従って、100μmの均一なサイズを有する球状の多数の注射懸濁液の形態で得ることができます。
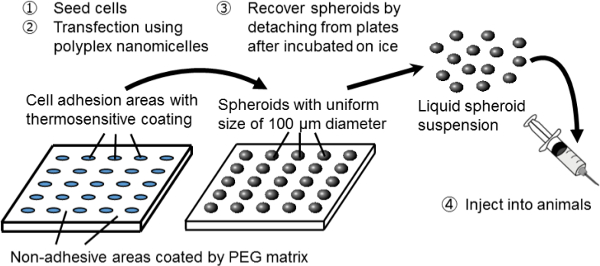
図1マイクロパターンプレート上でスフェロイド培養システムの概略図。遺伝的改変は、元の非ウイルス遺伝子キャリア、ポリプレックスナノミセルを用いた遺伝子導入によって達成されます。これは、プラスミドDNA(pDNAを)およびポリエチレングリコール(PEG)-polycationブロック共重合体11で構成されています。これらは、治療目的のために11細胞への安全かつ効果的な遺伝子導入を可能にする、PEGシェルと凝縮pDNAの内部コアからなる特徴的なコア-シェル構造を有している。 THIの拡大版を表示するには、こちらをクリックしてくださいのフィギュア。
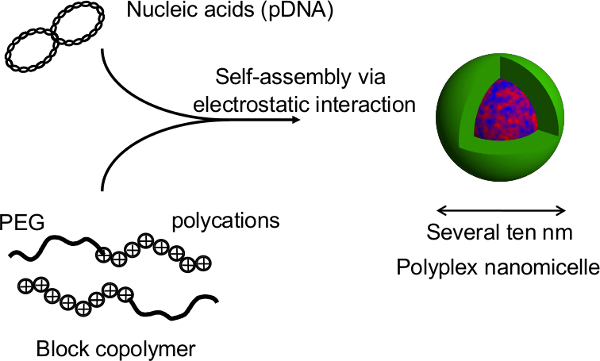
核酸およびPEG-ブロック-ポリカチオンブロック共重合体の複合体によって形成された。本研究ではポリプレックスナノミセルの図2の構造は 、この技術の主な利点は、回転楕円体の構造はナノミセルによる遺伝子トランスフェクションの際に破壊されないことです。ラット初代肝細胞スフェロイドのナノミセル媒介性トランスフェクションの後、長期の導入遺伝子の発現は、トランスフェクトしていないスフェロイド12のそれに匹敵するレベルで肝細胞からの連続アルブミン分泌と1ヶ月以上得られます。スフェロイドからの導入遺伝子発現およびアルブミン分泌も感熱プレートからの回復後も維持されています。これは、ナノミセル安全HEPの生来の機能を損なうことなく、遺伝子導入を容易にすることができることは明らかですatocytes。このように、ナノミセルを用いた遺伝子導入と感熱マイクロパターンプレート上で培養したスフェロイド細胞の組み合わせは、遺伝的に改変された細胞の移植のための有望なプラットフォームです。 この図の拡大版を表示するには、こちらをクリックしてください。
Protocol
Representative Results
Discussion
このプロトコルでは、遺伝子導入及びスフェロイド回収工程中のスフェロイドの3次元構造を維持することが重要です。細胞が細胞死または細胞活性の損失を回避することが有利な微小環境を維持するために不可欠です。従来の単層培養中の肝細胞が急速に数日12を播種した後、それらの分泌能力を失いつつ例えば、アルブミン分泌、肝細胞の代表的な先天性機能は、よく、肝細胞ス?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
私たちは深く感熱マイクロパターン培養プレートと同様に科学的助言を提供するための東洋合成工業、東京、日本の博士武池谷と技術スタッフに感謝します。また、動物実験での技術支援のためにさんさとみ小倉さん沙鈴木さんあすか三好さんとかつえ森井に感謝します。この作品は、財政的に日本学術振興会科研費科学研究費補助金によって部分的にサポートされていた、イノベーション(COI)プログラムのセンターと独立行政法人科学技術振興機構(JST)からのS-イノベーションプログラム、およびJSPSコア – のコアプログラム、A.先端研究ネットワーク。
Materials
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| collagenase | Wako Pure Chemical Industries | 639-00951 | |
| trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
References
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).

