在电气贯穿图(EPG)的韧皮部筛分子获取和测量电信号中的新应用
Summary
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
Abstract
细胞的电生理特性往往在体外研究,从他们的本地环境游离在他们之后。然而,遥远的细胞在生物体之间的电气传动的研究需要在体内 ,细胞嵌入在其天然环境无瑕疵的录音。电信号的传输距离伤员未受伤的地区在工厂已经长期以来引起了植物学家的利益。韧皮部,即传遍植物的植物脉管系统的生活的一部分,已被假定为在电传输在植物的主要组织。合适的电生理学方法的缺乏造成对的韧皮部细胞在体内的电特性的研究很多挑战。在这里,我们提出了一种新的方法来筛分子细胞内电(SES),采用活蚜虫,或其他韧皮部饲养昆虫半翅目,一体化的电气贯穿GRApH值(EPG)电路。的通用性,鲁棒性,以及该方法的准确度使得可以记录和详细研究的伤口诱导的电信号中的SE模式植物拟南芥 1的中央静脉。在这里,我们表明,EPG电极可以很容易地对社会企业在边际静脉内电生理记录来实现,以及研究社会企业与电信号响应几个外部刺激的能力。施加的SE的胞内电生理在EPG的方法可以被实现为多种植物物种的,在大量植物/昆虫组合,并为许多研究的目的。
Introduction
以产生长距离的电信号的能力是多细胞生物的一个有利的特征,可实现有效的响应外部刺激。这个特点已经独立进化在植物和动物,因此代表趋同进化的情况。鉴于电信号被耦合以在动物中重要的功能,例如刺激诱导在动物中的电信号的神经传递和肌肉收缩的分子基础,传输的机制和功能是深入研究的主题。相比之下,刺激诱导植物电信号传导很少受到关注的研究。虽然植物有没有神经或肌肉,似乎有足够的证据来假定刺激诱导的电信号在植物在其对环境的响应中发挥关键作用。
韧皮部,植物脉管系统的活组分,已被假定为主要的子施特拉特用于刺激诱 导的电信号的传输,从刺激/损坏到非刺激/未损坏区域2。主细胞中的韧皮部是筛网元件(SES),比较简单的,细长的细胞。的SE的端部被连接到其他的搜索引擎,形成一个连续,低电阻,筛筒系统,铺展整个植物。然而,有很少的研究在这些高度特化的细胞的电特性。在这些以往的研究中,研究人员访问与社会企业或者玻璃微电极3或与被耦合到玻璃电极厂插入蚜虫的钢丝,之后stylectomy(切割)4。玻璃微电极是由玻璃毛细管被拉到在一端与热成小于1微米的细尖直径,然后充入一个KCl溶液制成。甲的Ag / AgCl或铂丝插入到氯化钾填充的玻璃电极,然后连接到放大器输入端,和一个所指电极插入到所感兴趣的细胞周围的浴,在完成的电路。这种设置记录胞外指涉电极和细胞内测量电极, 即,在电池5的膜电位之间的电位差。用这种方法,Umrath从植物细胞制成的第一细胞内记录,使用藻类Nitella 6,7。Nitella是一个相对简单的生物体具有大的细胞,并因此适合于细胞内的电生理学实验。与此相反,细胞内的玻璃电极成多细胞三维陆生植物的小细胞的插入是技术要求高,需要高度熟练的研究人员,以及复杂的可视化,显微操作,和抗振动设备。虽然玻璃电极都适合从表层细胞的植物,如根表皮细胞8录制,细胞内recordin从细胞GS深深植根于植物的组织,如社会企业,很可能会造成的损害引起的反应,混乱的结果。在1989年,弗罗姆和Eschrich报道了用另一种方法,称为“蚜方法',其中玻璃电极连接到蚜虫钢丝stylectomy 4之后。蚜虫方法是微创的,因为柔性通管丝不会引起组织或细胞的损伤玻璃电极做。蚜虫口针是大自然的植物渗透伟大发明,和蚜虫是相当比人类寻找社企更熟练。不幸的是,这种方法蚜虫也是技术专长和装备方面要求极高。此外,每个实现此技术实验的成功完全取决于蚜虫在馈送模式为 – 具有稳定地插入到SE的管心针,在stylectomy的时间。在回顾性思维,人们可以看到,这项技术的成功的几率可能是我通过向实验装置的仪器,它允许识别所述蚜虫探针是否在SE施加stylectomy时mproved。
1964年,麦克莱恩和金赛所描述的“电子监控系统”对蚜虫的取食行为的实时9,10研究。在这个系统中,蚜虫和管心针穿透的植物被集成到一个电路。后来,在1978年,Tjallingii设计系统的修改的版本,称为“电气贯穿图形'(EPG)系统11,12。而原来的电子监控系统是电阻-起源电位敏感只,与EPG系统中,电动势(电动势)起源电位, 即,在植物中或在昆虫中产生,可以被记录在除了从所产生的电位电阻(R)中的昆虫。这是一个重要的改进,因为这两个信号分量,电动势和R,由蚜虫厂渗透过程中提供生物事件的相关信息。是什么使在EPG前置放大器敏感到R-部件是1GΩ,这是接近的植物/蚜虫抗性的平均值的其相对较低的输入电阻。一个小的偏置电压( 图1,V)为约100毫伏施加到植物,然后跨过植物和昆虫划分在一侧,而在另一输入电阻。的电压及其变化的点处( 图1A,B)中的昆虫和输入电阻之间测量。因此,R-分量表示偏移电压的植物蚜虫抗性调制,而电动势组件是植物电位在细探针顶端和潜力引起了昆虫的某一分数。该工厂的潜力 – 最相关的在这里 – 是由蚜虫口针刺破了植物细胞的主要膜电位。昆虫的潜力似乎主要两个探针运河内引起流体运动的流势, 即食品和唾液运河;没有内部神经或肌肉电位被记录在EPG。在实践中,细探针顶端用作电极尖端。所有植物细胞相对于内部带负电荷到正外的细胞。的电流( 即,在水溶液带电离子的移动)从内侧流向外侧, 反之亦然很由于细胞膜的高电阻的限制。通常静息电位保持恒定。然而,当负离子搬出或正离子通过细胞膜移动中,膜电位降低, 即,它的去极化“。去极化发生万一细胞激发。当特定的离子通道在膜被打开或当膜被破坏和离子泄漏和流出的离子然后移动或缩小。所有细胞具有离子通道和泵在叔他质膜带来的膜电位到其静止水平通过恢复细胞内的各种离子的初始浓度。静息电位及其变化是电动势组件,并且因此,在EPG的技术是适用于测量它们。
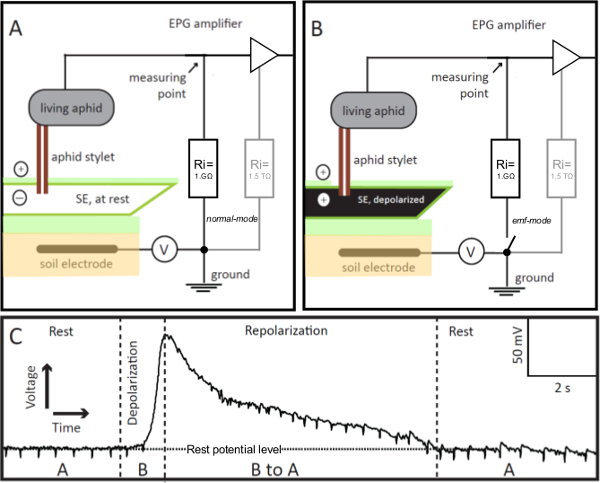
图1. EPG电极 。在EPG电极是活蚜虫集成到电气贯穿图(EPG)的电路,其通管针插入到在稳定的进给模式的筛元件(SE)。如果探针-刺穿SE是在休息(图A),在电路中,记录由EPG中的电压,是稳定的,在静息电位(图C,垫)。如果SE是兴奋,其膜去极化(图B),该可视化在EPG中电压(图C,去极化)逐渐增加。作为SE的离子平衡返回休息, 也就是说,它repolarizes,记录了电子节目指南的电压逐渐下降到静止电位电平(图C,复极化)。在图C中,“A”和“B”指的是在图A和B,分别示出的方案。 V =可调偏置电压源。 RI =输入电阻。在平行于1GΩ外部电阻,放大器有一个内部(在运放)高1.5TΩ电阻(图A和B,为灰色)。由开关的遥控器上的EPG前置放大器可以从正常到EMF模式,其允许获得高度精确的电压值来进行更改。 请点击此处查看该图的放大版本。
在接下来的部分,我们提供一个基本的协议执行EPG实验证明是有效的两种昆虫为重点和植物为重点的研究读者。
Protocol
Representative Results
Discussion
本文提供了制造电气贯穿图(EPG)记录了详细的方案。该EPG技术已经非常成熟,具有100-200活跃用户的全球,并已实施了不同主题的许多研究,例如:a)寄主植物的抗蚜虫等钢丝轴承昆虫13; B)植物病毒和病原体传播机构14; C)杀虫作用方式,(毒性和行为的变化)15; D)的EPG甚至是有益的证明蚜虫打架是有利的赢家,因为它增加了饲养效益16。
<p class="jove_content"…Divulgazioni
The authors have nothing to disclose.
Acknowledgements
VSR是由一个IIF居里夫人资助项目(缠绕地球,缩写:创伤诱导拟南芥电信号)。
Materials
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is x10 | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100Hz(softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
Riferimenti
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).

