師部ふるい要素に電気信号を取得し、測定するための電気浸透グラフ(EPG)の新しいアプリケーション
Summary
Electrical Penetration Graph (EPG) is a well-established technique for studying the feeding behavior of stylet-bearing insects. Here we show a new application of EPG as a non-invasive tool for the acquisition of intracellular electrophysiology recordings of sieve elements (SEs), the cells that form the phloem vasculature in plants.
Abstract
細胞の電気生理学的特性は、多くの場合、それらの天然の環境からそれらを解離した後、in vitroで検討されています。しかし、生体内の離れた細胞間の電気伝送の研究は、 生体内でそれらの天然の環境内に埋め込 まれた細胞のアーチファクトのない録音が必要です。工場で無傷の領域に負傷からの電気信号の伝送が長いので、植物学者の興味をそそりました。師部、植物全体に広がっている植物の血管系の住んでいる部分は、植物内の電気伝送における主要な組織として仮定されています。適切な電気生理学的方法の欠如は、in vivoでの師部細胞の電気的特性の研究のための多くの課題を提起します。ここでは、電気浸透GRAで統合された、生きているアブラムシを使用してふるい要素(SES)の細胞内電気生理学、または他の師部送り半翅目昆虫のための新しいアプローチを提示pH値(EPG)回路。この方法の汎用性、堅牢性、および精度により、記録し、モデル植物のシロイヌナズナ 1の中心静脈からのSEに詳細に傷誘導性の電気信号を調べるために行きました。ここでは、EPG電極を容易に限界静脈内のSEの細胞内電気生理学的記録のために実施することができるだけでなく、いくつかの外部刺激に電気信号に応答するのSEの能力を研究することを示しています。 EPGのアプローチは、細胞内のSEの電気生理学に適用植物/昆虫組み合わせの多数であり、多くの研究目的のために、植物種の多種多様に実施することができます。
Introduction
長距離電気信号を生成する能力は、外部刺激に対する効率的な応答を可能にする多細胞生物の有利な特性です。この特性は、植物および動物において独立して進化し、したがって、収束進化の場合を示しています。電気信号は、例えば、神経伝達や筋肉の収縮、分子的基礎、変速機の機構、および動物における刺激によって誘発される電気信号の関数として、動物で重要な機能に結合されていることを考えると、集中的な研究の対象です。これとは対照的に、植物中の刺激によって誘発される電気信号は、ほとんどの研究が注目されています。植物には神経や筋肉を持っていないが、植物中の刺激によって誘発される電気信号は、環境因子への応答に重要な役割を果たしていることを前提とするのに十分な証拠があるように思われます。
師部、植物の血管系の生体成分は、主要なサブように仮定されています刺激によって誘発される電気信号を伝送するためのstrateは、刺激から/非刺激/非損傷領域2に損傷を受けました。師部の主な細胞は、篩エレメント(SES)、比較的単純な、細長い細胞です。のSEの端部は、植物全体に広がっている連続的な、低抵抗、篩管系を形成する、他のSEに接続されています。これらの高度に特殊化した細胞の電気的特性に非常に少数の研究は、しかし、があります。これらの以前の研究では、研究者は、ガラス微小電極3またはstylectomy(切断)4の後に、アブラムシの植物挿入スタイレットに結合させたガラス電極とのいずれかでのSEにアクセスしました。ガラス微小電極は、直径1μm未満の微細な先端に熱と一端で引っ張り、その後、KCl溶液で満たされたガラス毛細管から作製されます。のKCl充填ガラス電極に挿入されたAg / AgClの又は白金線、次にアンプの入力に接続されており、参照先電極は、回路を完成する、目的の細胞を囲む浴中に挿入されます。このセットアップでは、細胞外の参照先電極および細胞内測定電極、 すなわち、セル5の膜電位との電位差を記録します。この方法では、Umrathは藻類フラスコモ 6,7を用いて、植物細胞からの第1の細胞内記録を作った。 フラスコモは、比較的単純な大きな細胞と生物、および細胞内電気生理学実験することが適しています。対照的に、多細胞、三次元陸生植物の細胞への細胞内小ガラス電極の挿入は、技術的に要求が厳しい、高度に熟練した研究者だけでなく、高度な可視化、マイクロマニピュレーション、および防振装置を必要とします。ガラス電極は、根の表皮細胞8などの植物における表層細胞から記録するのに適しているが、細胞内recordinこのようなSEが、結果を混乱可能性が高い原因の損傷によって誘発される応答として深く植物の組織に埋め込まれた細胞からGS、。 1989年に、フロムとEschrichガラス電極をstylectomy 4後アブラムシのスタイレットに結合されている「アブラムシ法」と呼ばれる別の方法を使用することを、報告しました。ガラス電極がそうであるように柔軟なスタイレットは、組織または細胞の損傷を引き起こすことはありませんので、アブラムシの方法は、低侵襲性です。アブラムシのスタイレットは、植物の浸透のため、自然の偉大な発明であり、アブラムシがかなりのSEを見つけることで、人間よりも熟練しています。残念ながら、このアブラムシ方法は、技術的な専門知識と設備の面で非常に厳しいです。 stylectomy時、安定SEに挿入スタイレットと – また、この技術を実装し、各実験の成功は、給電モードであるアブラムシに完全に依存します。遡及的に考えて、一つは、この技術の成功の確率は私だったかもしれないことがわかります実験にstylectomyを適用する場合アブラムシスタイレットがSEであるか否かを識別することができる機器を追加することによってmproved。
1964年に、マクリーンとキンゼイはリアルタイム9,10にアブラムシの摂食行動の研究のための「電子監視システム」を記載しました。このシステムでは、アブラムシ及びスタイレット-浸透プラントは、電気回路に集積されました。その後、1978年に、Tjallingiiは、システムの修正版を考案した「電気浸透グラフ」(EPG)システム11,12と呼ばれます。オリジナルの電子監視システムは、EPGシステムと、起電力(EMF)が電位を発し、抵抗のみ由来の電位に対して感受性であった、すなわち、植物または昆虫で生成から生じる電位に加えて記録することができたのに対し昆虫の抵抗(R)。両方の信号成分、起電力及びRので、これは重要な改善を示し、アブラムシによる植物への浸透中にイベントの生物学的な関連情報を提供。何R-コンポーネントへのEPGプリアンプが敏感になることは、植物/アブラムシ抵抗の平均値の近くに位置しています1GΩ、その比較的低い入力抵抗です。小さ なオフセット電圧( 図1には 、V)は、約+100 mVのでは、1つの側に、植物と昆虫に分割されている植物、および他の入力抵抗に印加されます。電圧及びその変化は、昆虫および入力抵抗との間の点( 図1A、B)で測定されます。 EMF-成分が昆虫に起因する植物スタイレット先端の電位と電位の一定の割合であるのに対し、このため、R-コンポーネントは、オフセット電圧の植物アブラムシ抵抗変調を表します。ここで最も関連性 – – 植物の電位は、アブラムシのスタイレットを穿刺植物細胞の主に膜電位です。昆虫電位が主であると思われます2スタイレット運河内の流体の動きによって引き起こされるストリーミング電位、 すなわち、食品や唾液運河。は内部の神経や筋肉の電位は、EPGに記録されていません。実際には、電極先端としてスタイレット先端機能します。すべての植物細胞は負電池の正外側に対して内側に充電されます。電流( すなわち、水溶液中の荷電イオンの移動)内側から外側に流れ、 その逆が原因細胞膜の高抵抗に非常に限られています。通常、静止電位が一定に保たれます。しかし、マイナスイオンが出て移動したり、正イオンが細胞膜を通って移動し、膜電位が低下すると、 すなわち、それは「脱分極します」。脱分極は、セルの励起の場合に発生します。イオンは、膜中の特定のイオンチャネルが開いているか、膜が損傷した場合やイオンが内外に漏れるときにアウトに移動したり。すべての細胞は、T中のイオンチャネルおよびポンプを持っています彼は細胞内の種々のイオンの最初の濃度を復元することによってその静止レベルに膜電位を持った膜をプラズマ。静止電位とその変化が起電力成分であり、従って、EPGの技術は、それらを測定するのに適しています。
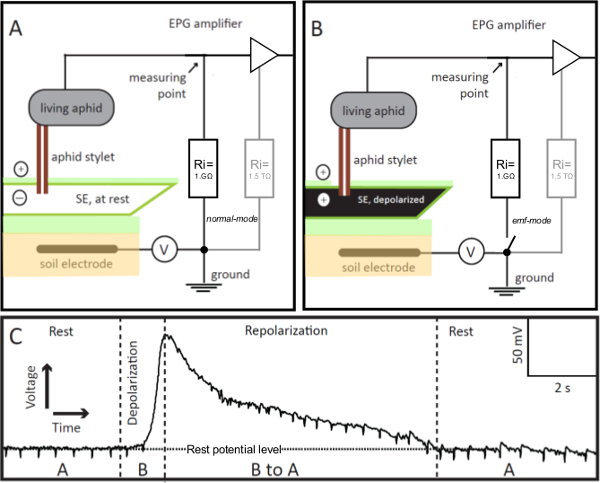
1. EPG電極図 。 EPG電極は、その安定したスタイレット給電モードで篩エレメント(SE)に挿入された電気浸透グラフ(EPG)回路に組み込ま生きアブラムシあります。スタイレット-刺しSEが残り(パネルA)である場合には、EPGによって記録された回路の電圧は、安定しており、静止電位レベル(パネルC、REST)です。 SEが励起される場合、電圧が徐々に増加する(パネルC、脱分極)のように、EPGで可視化され、その膜の脱分極(パネルB)、。 SE中のイオンバランスを休まに戻るように、 すなわち、それrepolar化し、EPGにより記録された電圧は徐々に静止電位レベル(パネルC、再分極)に減少します。パネルCは、「A」及び「B」は、それぞれパネルAおよびBに示されたシナリオを参照します。 V =可変オフセット電圧源。 riは=入力抵抗。 1GΩ外付け抵抗と並行して、アンプが(灰色で、パネルAおよびB)高1.5TΩ抵抗(オペアンプ)で内部があります。スイッチのリモコンでのEPGプリアンプは、高精度の電圧値を得ることができ、モードをEMFために、通常から変更することができます。 この図の拡大版を表示するには、こちらをクリックしてください。
次のセクションでは、両方の集束昆虫や植物に焦点を当てた研究のために有効であるEPG実験を行うための基本的なプロトコルを読者に提供します。
Protocol
Representative Results
Discussion
この記事では、電気浸透グラフ(EPG)の記録を作成するための詳細なプロトコルを提供します。 EPG技術はよく、世界中の100〜200のアクティブユーザーと、確立され、それは、例えば、さまざまなトピックに関する多くの研究のために実装されました:アブラムシや他のスタイレット保有昆虫13 a)の宿主植物の抵抗性を、 B)植物ウイルスおよび病原体伝達機構14と 、アクシ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
VSRは、IIFマリー·キュリー·グラント(: シロイヌナズナで電気信号を誘導した創傷EARTHにおける創傷の略)によってサポートされていました。
Materials
| Brass connector pins | EPG Systems/hardw.shop | Φ 1.2 mm | |
| Thin copper wire | EPG Systems/hardw.shop | approx. Φ 0.2 mm | |
| Thin gold wire | EPG Systems | Φ 18 µm | |
| Soldering fluid | hardware shop | matching the soldering wire | |
| Resin-cored soldering wire | hardware shop | ||
| Styrofoam | any | ||
| Water-based silver glue | EPG systems | recipe in: www.epgsystems.eu | |
| Paper wipes | Kimberly-Clark | 5511 | |
| Soldering bolt | any | ||
| Stereomicroscope | Hund Wetzlar | minimum magnification is x10 | |
| Small scissors | Fine Science Tools | 14088-10 | |
| Scalpel | Fine Science Tools | 10050-00 | |
| Fine forceps | Fine Science Tools | 11231-20 | |
| Vortex | A. Hartenstein | L46 | |
| Watercolor brushes | any | Number 1 or 2 | |
| Air suction device | see description in: www.epgsystems.eu | ||
| Insect pins | any | No. 1 or 2 | |
| Solid table | |||
| Faraday cage | Hand made | ||
| Computer | Fujitsu Siemens | ||
| Data acquisition software | EPG Systems | Stylet+d | |
| Giga-4 (-8) Complete System | EPG Systems | ||
| includes the following: | |||
| Main control box with USB output | Di155/Di710 | 12/14 bit, rate 100Hz(softw. fixed) | |
| EPG probes 4 (8) | 50x DC pre-amplifier | ||
| Swivel clamps on rod | |||
| DC power adaptor | bipolar, 230/115 VAC to -/+8 VDC | ||
| Plant electrodes and cables | |||
| Additional test and ground cables |
Riferimenti
- Salvador-Recatalà, V., Tjallingii, W. F., Farmer, E. E. Real-time, in vivo. intracellular recordings of caterpillar-induced depolarization waves in sieve elements using aphid electrodes. New Phytologist. 203 (2), 674-684 (2014).
- Van Bel, A. J., Knoblauch, M., Furch, A. C., Hafke, J. B. (Questions)n on phloem biology. 1. Electropotential waves, Ca2+ fluxes and cellular cascades along the propagation pathway. Plant Science. 181 (3), 210-218 (2011).
- Rhodes, J. D., Thain, J. F., Wildon, D. C. The pathway for electrical signal conduction in the wounded tomato plant. Planta. 200, 50-57 (1996).
- Fromm, J., Eschrich, W. Correlation of ionic movements with phloem unloading and loading in barley leaves. Plant Physiology and Biochemistry. 27, 577-585 (1989).
- Brette, R., Destexhe, A., Brette, R., Destexhe, A. Intracellular Recordings. Handbook of Neural Activity Measurement. , 44-91 (2012).
- Umrath, K. Untersuchungen über Plasma und Plasamstromung an Characeen. IV. Potentialmessungen an Nitella mucronata. mit besonderer Berücksichtingung der Erregungserscheinungen. Protoplasma. 9, 576-597 (1930).
- Umrath, K. Der Erregungsvorgang bei Nitella mucronata. Protoplasma. 17, 258-300 (1932).
- Carden, D. E., Walker, D. J., Flowers, T. J., Miller, A. J. Single-cell measurements of the contribution of cytosolic Na+ and K+ to salt tolerance. Plant Physiology. 131 (2), 676-683 (2003).
- Miles, P. W., McLean, D. L., Kinsey, M. G. Evidence that two species of aphid ingest food through an open stylet sheath. Experientia. 20 (10), 582 (1964).
- McLean, D. L., Kinsey, M. G. A technique for electronically recording aphid feeding and salivation. Nature. 202, 1358-1359 (1965).
- Tjallingii, W. F. Electronic recording of penetration behaviour by aphids. Entomologia Experimentalis et Applicata. 24, 721-730 (1978).
- Tjallingii, W. F. Membrane potentials as an indication for plant cell penetration by aphid stylets. Entomologia Experimentalis et Applicata. 38, 187-193 (1985).
- Alvarez, E. E., et al. Comparative analysis of Solanum stoloniferum. responses to probing by the green peach aphid Myzus persicae. and the potato aphid Macrosiphum euphorbiae. Insect Science. 20 (2), 207-227 (2013).
- Carmo-Sousa, M., Moreno, A., Garzo, E., Fereres, A. A non-persistently transmitted virus induces a pull-push strategy in its aphid vector to optimize transmission and spread. Virus Research. 186, 38-46 (2014).
- Jacobson, A. L., Kennedy, G. G. Electrical Penetration Graph studies to investigate the effects of cyantraniliprole on feeding behavior of Myzus persicae. (Hemiptera: Aphididae) on Capsicum annuum. Pest Management Science. 70 (5), 836-840 (2014).
- Morris, G., Foster, W. A. Duelling aphids: electrical penetration graphs reveal the value of fighting for a feeding site. Journal of Experimental Biology. 211 (9), 1490-1494 (2008).

