経皮的電気神経刺激を使用した神経筋機能の評価
Summary
We present a protocol to assess changes in neuromuscular function. Percutaneous electrical nerve stimulation is a non-invasive method that evokes muscular responses. Electrophysiological and mechanical properties of these responses permit the evaluation of neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels).
Abstract
Percutaneous electrical nerve stimulation is a non-invasive method commonly used to evaluate neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels). The present protocol describes how this method can be used to stimulate the posterior tibial nerve that activates plantar flexor muscles. Percutaneous electrical nerve stimulation consists of inducing an electrical stimulus to a motor nerve to evoke a muscular response. Direct (M-wave) and/or indirect (H-reflex) electrophysiological responses can be recorded at rest using surface electromyography. Mechanical (twitch torque) responses can be quantified with a force/torque ergometer. M-wave and twitch torque reflect neuromuscular transmission and excitation-contraction coupling, whereas H-reflex provides an index of spinal excitability. EMG activity and mechanical (superimposed twitch) responses can also be recorded during maximal voluntary contractions to evaluate voluntary activation level. Percutaneous nerve stimulation provides an assessment of neuromuscular function in humans, and is highly beneficial especially for studies evaluating neuromuscular plasticity following acute (fatigue) or chronic (training/detraining) exercise.
Introduction
経皮的電気神経刺激は広く神経筋機能1を評価するために使用されます 。基本的な原理は、筋肉の収縮を誘発する末梢運動神経に電気刺激を誘導することで構成されています。機械(トルク測定)および電気(筋電図活動)応答が同時に記録されます。考え接合部に記録されたトルクは、エルゴメーターを用いて評価されます。表面電極を用いて記録された筋電(EMG)信号は、2筋の活動を表すことが示されています。この非侵襲的な方法は、痛みを伴う、より簡単に筋肉の録音よりも実装されていません。単極および双極の両方の電極を使用することができます。単極電極構成は、小さな筋肉のために有用である筋活動3の変化に敏感であることが示されています。しかし、バイポーラ電極は、信号対雑音Rの改善に、より有効であることが示されましたatio 4最も一般的に記録し、モータユニットの活性を定量化する方法として使用されています。以下で説明する方法は、バイポーラの録音に焦点を当てます。 EMG活動は、神経筋システムの有効性および完全性の指標です。経皮的神経刺激の使用は、神経筋機能に筋肉、脊髄、または超脊髄レベルでの変化、すなわち ( 図1)、さらに洞察を提供しています。
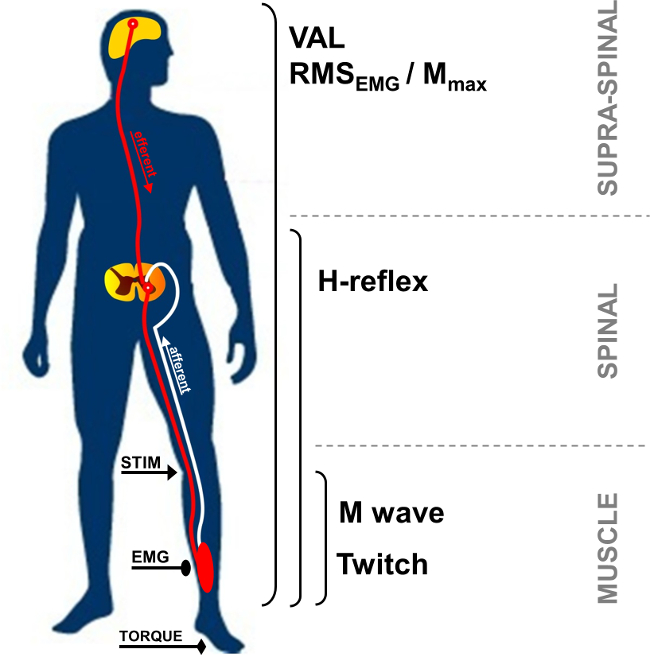
図1:神経筋測定の概要 STIM:神経刺激。 EMG:電。 VAL:自主活性化レベル。 RMS:二乗平均平方根。 Mの最大:最大M波振幅。
安静時、また、M波と呼ばれる複合筋活動電位は、刺激アーチファクト後に観察された短い待ち時間応答であり、直接ACTIVによって励起筋肉量を表し、筋肉につながる運動軸索のエーション( 図2、数3)。 M波振幅がその最大値のプラトーに達するまでの強度で増加します。 M 最大と呼ばれるこの応答は、表面筋電図電極 5の下に記録されたすべてのモータユニットおよび/ または筋線維の活動電位の同期加算を表します。ピーク・ツー・ピーク振幅または波領域の進化は、神経筋伝達6の変化を識別するために使用されます。 M波、 すなわちピーク筋トルク/力に関連した機械的応答の変化が原因で、筋肉の興奮性および/ または筋線維7内の変化である可能性があります。 M の最大振幅値とピークの関連付けは、けいれんトルク振幅白金(Pt / M比)、すなわち与えられた電気モータ指令のための機械的な応答、筋肉8の電気効率の指標を提供します。
52974 / 52974fig2.jpg "/>
図2:モーターと神経刺激によって活性化再帰経路混合(モーター/感覚)神経(STIM)の電気刺激は、モータ軸索およびIa求心性発射の両方の脱分極を誘導します。脊髄に向けてのIa求心性神経の脱分極は、順番に、H-反射反応(経路1 + 2 + 3)を連想させるアルファ運動ニューロンを活性化します。 M波(経路3):刺激強度に応じて、モータ軸索の脱分極は、直接筋肉の反応を呼び起こします。最大M波の強度で、逆行性電流は、(3 ')が生成され、反射ボレー(2)に衝突します。この衝突は、部分的または完全に、H-反射反応をキャンセルします。
H-反射は、IA-αの運動ニューロンのシナプス9の変化を評価するために使用される電気生理学的応答です。このパラメータは、安静時または自発的収縮の間に評価され得ます。 H-反射は伸張反射の変形を表す( 図2、NUmber 1-3)。 H-反射はmonosynaptically Iaの求心性経路10,11によって動員モータユニットを活性化し、末梢および中枢の影響12を施すことができます。 H-反射を誘発する方法は、安静時および13,14等尺性収縮15中脊髄興奮性を評価するための高被検体内の信頼性を有することが知られています。
随意収縮の間、自発的な神経ドライブの大きさは、EMG信号の振幅を用いて評価することができ、一般的に二乗平均平方根を用いて定量化(RMS)。 RMS EMGは、一般的に随意収縮( 図1)の間に運動系の興奮のレベルを定量化する手段として使用されます。そのため内および被験者間変動16の、RMS EMGは筋特異的最大随意収縮(RMS EMGmax)中に記録された筋電図を用いて正規化する必要があります。加えて、EMG信号の変化をbことがあるので周辺レベルでの変化に起因する電子は、このようなM波などの周辺パラメータを使用して、正規化は、EMG信号の唯一の中心的要素を評価することが要求されます。これは、M波の最大振幅またはRMS 値MmaxによりRMS EMGを分割することによって行うことができます。それを考慮にM波期間17の可能な変更を要するとして、RMS 値Mmax( すなわち RMS EMG / RMS 値Mmax)を使用して、正規化は、好ましい方法です。
運動コマンドは、自発的な活性化レベル(VAL)を計算することにより評価することができます。この方法は、最大随意収縮時のM の最大強度で電気刺激を重ね合わせることにより攣縮補間技術18を使用しています 。神経を刺激することによって誘導され、余分なトルクは、弛緩した筋肉増強19に同一の神経刺激によって生成された制御攣縮と比較されます。最大VAL、元の単収縮interpoを評価するために、マートン18によって説明レーション技術は、随意収縮の上に補間され、単一の刺激を必要とします。誘発トルク増分は、単一の刺激応答20に比べて、より大きな、より容易に検出され、より少ない変数であるため、最近では、対になった刺激の使用は、より一般的になってきています。 VALは、最大限の作業の筋肉21を活性化するために、中枢神経系の能力の指標を提供します。現在、VALは単収縮補間技術を使用すると、筋肉の活性化22のレベルを評価する最も貴重な方法で評価しました。また、エルゴメーターを用いて評価し、ピークトルクは、研究と臨床現場での使用の23の適用最も適切研究強度試験パラメータがあります。
電気神経刺激は、筋群(例えば、肘屈筋、手首の屈筋、膝伸展、足底屈筋)の様々な使用することができます。しかし、神経のアクセシビリティが作りますいくつかの筋肉群で難しい技術。足底屈筋、特に下腿三頭筋(ヒラメ筋とgastrocnemiusの複数形)の筋肉は、しばしば文献24において検討されています。実際、これらの筋肉は、彼らの特定の関心を正当化する、移動に関与しています。刺激部位及び記録電極間の距離は、下腿三頭筋の異なる誘発波の同定を可能にします。膝窩で脛骨神経と多数のスピンドルの表面的な部分は、簡単に他の筋肉24に比べて反射応答を記録することを可能にします。これらの理由から、現在提示反射方法は、筋(ヒラメ筋と腓腹筋)の下腿三頭筋のグループに焦点を当てています。このプロトコルの目的は、下腿三頭筋における神経筋機能を調査するために経皮的神経刺激法を記述することです。
Protocol
Representative Results
Discussion
経皮的神経刺激は、健康なヒトにおける神経運動機能の基本的な制御を理解するだけでなく、疲労や訓練17を介して 、急性または慢性の適応を分析できるようにするだけでなく、神経筋システムの多数の特性の定量化を可能にします。これは、特に測定値が急速に回復42の影響を回避するために、運動終了後できるだけ早く実行する必要があり疲労プロトコルのために非常に?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors have no acknowledgements.
Materials
| Biodex dynamometer | Biodex Medical System Inc., New York, USA | www.biodex.com | |
| MP150 Data Acquisition System | Biopac Systems Inc., Goleta, USA | ||
| Acknowledge 4.1.0 software | Biopac Systems Inc., Goleta, USA | www.biopac.com | |
| DS7A constant current high voltage stimulator | Digitimer, Hertfordshire, UK | www.digitimer.com | |
| Silver chloride surface electrodes | Control Graphique Medical, Brie-Comte-Robert, France | ||
| Computer | |||
| 1 Cable for connecting the Biodex to the MP150 | |||
| 1 Cable for connecting the Digitimer to the MP150 | |||
| 1 Cable for connecting the MP150 to the computer |
References
- Desmedt, J. E., Hainaut, K. Kinetics of myofilament activation in potentiated contraction staircase phenomenon in human skeletal muscle. Nature. 217 (5128), 529-532 (1968).
- Bouisset, S., Maton, B. Quantitative relationship between surface EMG and intramuscular electromyographic activity in voluntary movement. American Journal of Physical Medicine. 51 (6), 285-295 (1972).
- Gabriel, D. A. Effects of monopolar and bipolar electrode configurations on surface EMG spike analysis. Medical Engineering and Physics. 33 (9), 1079-1085 (2011).
- Merletti, R., Rainoldi, A., Farina, D. Surface electromyography for noninvasive characterization of muscle. Exercise and Sport Sciences Reviews. 29 (1), 20-25 (2001).
- Lepers, R. Aetiology and time course of neuromuscular fatigue during prolonged cycling exercises. Science, & Motricité. 52, 83-107 (2004).
- Baudry, S., Klass, M., Pasquet, B., Duchateau, J. Age related fatigability of the ankle dorsiflexor muscles during concentric and eccentric contractions. European Journal of Applied Physiology. 100 (5), 515-525 (2007).
- Place, N., Yamada, T., Bruton, J. D., Westerblad, H. Muscle fatigue From observations in humans to underlying mechanisms studied in intact single muscle fibres. European Journal of Applied Physiology. 110 (1), 1-15 (2010).
- Scaglioni, G., Narici, M. V., Maffiuletti, N. A., Pensini, M., Martin, A. Effect of ageing on the electrical and mechanical properties of human soleus motor units activated by the H reflex and M wave. The Journal of Physiology. 548 (Pt. 2), 649-661 (2003).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Pierrot Deseilligny, E., Burke, D. . The circuitry of the human spinal cord: its role in motor control and movement disorders. , (2005).
- Duclay, J., Pasquet, B., Martin, A., Duchateau, J. Specific modulation of corticospinal and spinal excitabilities during maximal voluntary isometric shortening and lengthening contractions in synergist muscles. The Journal of Physiology. 589 (Pt. 11), 2901-2916 (2011).
- Grosprêtre, S., Papaxanthis, C., Martin, A. Modulation of spinal excitability by a sub threshold stimulation of M1 area during muscle lengthening. Neuroscience. 263, 60-71 (2014).
- Mynark, R. G. Reliability of the soleus H reflex from supine to standing in young and elderly. Clinical Neurophysiology. 116 (6), 1400-1404 (2005).
- Palmieri, R. M., Hoffman, M. A., Ingersoll, C. D. Intersession reliability for H reflex measurements arising from the soleus peroneal and tibialis anterior musculature. The International Journal of Neuroscience. 112 (7), 841-850 (2002).
- Chen, Y. S., Zhou, S., Cartwright, C., Crowley, Z., Baglin, R., Wang, F. Test retest reliability of the soleus H reflex is affected by joint positions and muscle force levels. Journal of Electromyography and Kinesiology. 20 (5), 987-987 (2010).
- Lehman, G. J., McGill, S. M. The importance of normalization in the interpretation of surface electromyography A proof of principle. Journal of Manipulative and Physiological Therapeutics. 22 (7), 444-446 (1999).
- Lepers, R. Interest and limits of percutaneous nerve electrical stimulation in the evaluation of muscle fatigue. Science, & Motricité. 70 (70), 31-37 (2010).
- Merton, P. A. Voluntary strength and fatigue. The Journal of Physiology. 123, 553-564 (1954).
- Gandevia, S. C. Spinal and supraspinal factors in human muscle fatigue. Physiological Reviews. 81 (4), 1725-1789 (2001).
- Shield, A., Zhou, S. Assessing voluntary muscle activation with the twitch interpolation technique. Sports Medicine. 34 (4), 253-267 (2004).
- Rozand, V., Pageaux, B., Marcora, S. M., Papaxanthis, C., Lepers, R. Does mental exertion alter maximal muscle activation. Frontiers in Human Neuroscience. 8, 755 (2014).
- Place, N., Maffiuletti, N. A., Martin, A., Lepers, R. Assessment of the reliability of central and peripheral fatigue after sustained maximal voluntary contraction of the quadriceps muscle. Muscle and Nerve. 35 (4), 486-495 (2007).
- Kannus, P. Isokinetic evaluation of muscular performance: implications for muscle testing and rehabilitation. International Journal of Sports Medicine. 15, S11-S18 (1994).
- Tucker, K. J., Tuncer, M., Türker, K. S. A review of the H reflex and M wave in the human triceps surae. Human Movement Science. 24 (5-6), 667-688 (2005).
- Taylor, N. A., Sanders, R. H., Howick, E. I., Stanley, S. N. Static and dynamic assessment of the Biodex dynamometer. European Journal of Applied Physiology and Occupational Physiology. 62 (3), 180-188 (1991).
- Sale, D., Quinlan, J., Marsh, E., McComas, A. J., Belanger, A. Y. Influence of joint position on ankle plantarflexion in humans. Journal of Applied Physiology. 52 (6), 1636-1642 (1982).
- Cattagni, T., Martin, A., Scaglioni, G. Is spinal excitability of the triceps surae mainly affected by muscle activity or body position. Journal of Neurophysiology. 111 (12), 2525-2532 (2014).
- Gerilovsky, L., Tsvetinov, P., Trenkova, G. Peripheral effects on the amplitude of monopolar and bipolar H-reflex potentials from the soleus muscle. Experimental Brain Research. 76 (1), 173-181 (1989).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Hermens, H. J., Freriks, B., Disselhorst Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. Journal of Electromyography and Kinesiology. 10 (5), 361-374 (2000).
- Kamen, G., Sison, S. V., Du, C. C., Patten, C. Motor unit discharge behavior in older adults during maximal effort contractions. Journal of Applied Physiology. 79 (6), 1908-1913 (1995).
- Neyroud, D., Rüttimann, J., et al. Comparison of neuromuscular adjustments associated with sustained isometric contractions of four different muscle groups. Journal of Applied Physiology. 114, 1426-1434 (2013).
- Rupp, T., Girard, O., Perrey, S. Redetermination of the optimal stimulation intensity modifies resting H-reflex recovery after a sustained moderate-intensity muscle contraction. Muscle and Nerve. 41 (May), 642-650 (2010).
- Zehr, E. P. Considerations for use of the Hoffmann reflex in exercise studies. European Journal of Applied Physiology. 86 (6), 455-468 (2002).
- Gondin, J., Duclay, J., Martin, A. Soleus and gastrocnemii evoked V wave responses increase after neuromuscular electrical stimulation training. Journal of Neurophysiology. 95 (6), 3328-3335 (2006).
- Rochette, L., Hunter, S. K., Place, N., Lepers, R. Activation varies among the knee extensor muscles during a submaximal fatiguing contraction in the seated and supine postures. Journal of Applied Physiology. 95 (4), 1515-1522 (2003).
- Fuglevand, A. J., Zackowski, K. M., Huey, K. A., Enoka, R. M. Impairment of neuromuscular propagation during human fatiguing contractions at submaximal forces. The Journal of Physiology. 460, 549-572 (1993).
- Vandervoort, A. A., McComas, A. J. Contractile changes in opposing muscles of the human ankle joint with aging. Journal of Applied Physiology. 61 (1), 361-367 (1986).
- Grosprêtre, S., Martin, A. Conditioning effect of transcranial magnetic stimulation evoking motor evoked potential on V wave response. Physiological Reports. 2 (11), e12191 (2014).
- Allen, G. M., Gandevia, S. C., McKenzie, D. K. Reliability of measurements of muscle strength and voluntary activation using twitch interpolation. Muscle and Nerve. 18 (6), 593-600 (1995).
- Cooper, M. A., Herda, T. J., Walter Herda, A. A., Costa, P. B., Ryan, E. D., Cramer, J. T. The reliability of the interpolated twitch technique during submaximal and maximal isometric muscle actions. Journal of Strength and Conditioning Research. 27 (10), 2909-2913 (2013).
- Froyd, C., Millet, G. Y., Noakes, T. D. The development of peripheral fatigue and short term recovery during self paced high intensity exercise. The Journal of Physiology. 591 (Pt 5), 1339-1346 (2013).
- Pierrot Deseilligny, E., Morin, C., Bergego, C., Tankov, N. Pattern of group I fibre projections from ankle flexor and extensor muscles in man. Experimental Brain Research. 42 (3-4), 337-350 (1981).
- Brooke, J. D., McIlroy, W. E., et al. Modulation of H reflexes in human tibialis anterior muscle with passive movement. Brain Research. 766 (1-2), 236-239 (1997).
- Hultborn, H., Meunier, S., Morin, C., Pierrot Deseilligny, E. Assessing changes in presynaptic inhibition of I a fibres a study in man and the cat. The Journal of Physiology. 389, 729-756 (1987).
- Meunier, S., Pierrot Deseilligny, E. Cortical control of presynaptic inhibition of Ia afferents in humans. Experimental Brain Research. 119 (4), 415-426 (1998).
- Aymard, C., Baret, M., Katz, R., Lafitte, C., Pénicaud, A., Raoul, S. Modulation of presynaptic inhibition of la afferents during voluntary wrist flexion and extension in man. Experimental Brain Research. 137 (1), 127-131 (2001).
- Abbruzzese, G., Trompetto, C., Schieppati, M. The excitability of the human motor cortex increases during execution and mental imagination of sequential but not repetitive finger movements. Experimental Brain Research. 111 (3), 465-472 (1996).
- Garland, S. J., Klass, M., Duchateau, J. Cortical and spinal modulation of antagonist coactivation during a submaximal fatiguing contraction in humans. Journal of Neurophysiology. 99, 554-563 (2008).
- Rodriguez Falces, J., Place, N. Recruitment order of quadriceps motor units Femoral nerve vs direct quadriceps stimulation. European Journal of Applied Physiology. 113, 3069-3077 (2013).
- Rodriguez Falces, J., Maffiuletti, N. A., Place, N. Spatial distribution of motor units recruited during electrical stimulation of the quadriceps muscle versus the femoral nerve. Muscle and Nerve. 48 (November), 752-761 (2013).
- Bathien, N., Morin, C. Comparing variations of spinal reflexes during intensive and selective attention (author’s transl). Physiology, & Behavior. 9 (4), 533-538 (1972).
- Earles, D. R., Koceja, D. M., Shively, C. W. Environmental changes in soleus H reflex excitability in young and elderly subjects. The International Journal of Neuroscience. 105 (1-4), 1-13 (2000).
- Paquet, N., Hui Chan, C. W. Human soleus H reflex excitability is decreased by dynamic head and body tilts. Journal of Vestibular Research Equilibrium, & Orientation. 9 (5), 379-383 (1999).
- Miyahara, T., Hagiya, N., Ohyama, T., Nakamura, Y. Modulation of human soleus H reflex in association with voluntary clenching of the teeth. Journal of Neurophysiology. 76 (3), 2033-2041 (1996).
- Pinniger, G. J., Nordlund, M. M., Steele, J. R., Cresswell, a. GH reflex modulation during passive lengthening and shortening of the human triceps surae. Journal of Physiology. 534 (Pt 3), 913-923 (2001).
- Tallent, J., Goodall, S., Hortobágyi, T., St Clair Gibson, A., French, D. N., Howatson, G. Repeatability of corticospinal and spinal measures during lengthening and shortening contractions in the human tibialis anterior muscle). PLoS ONE. 7 (4), e35930 (2012).
- Grospretre, S., Martin, A. H. reflex and spinal excitability methodological considerations. Journal of Neurophysiology. 107 (6), 1649-1654 (2012).
- Hugon, M. Methodology of the Hoffmann reflex in man. New Developments in Electromyography and Chemical Neurophysiology. 3m, 277-293 (1973).
- Bigland Ritchie, B., Zijdewind, I., Thomas, C. K. Muscle fatigue induced by stimulation with and without doublets. Muscle and Nerve. 23 (9), 1348-1355 (2000).
- Kent Braun, J. A., Le Blanc, R. Quantitation of central activation failure during maximal voluntary contractions in humans. Muscle and Nerve. 19 (7), 861-869 (1996).
- Herbert, R. D., Gandevia, S. C. Twitch interpolation in human muscles mechanisms and implications for measurement of voluntary activation. Journal of Neurophysiology. 82, 2271-2283 (1999).
- Miller, M., Downham, D., Lexell, J. Superimposed single impulse and pulse train electrical stimulation A quantitative assessment during submaximal isometric knee extension in young healthy men. Muscle and Nerve. 22 (8), 1038-1046 (1999).
- Button, D. C., Behm, D. G. The effect of stimulus anticipation on the interpolated twitch technique. Journal of Sports Science and Medicine. 7 (4), 520-524 (2008).
- Goss, D. a., Hoffman, R. L., Clark, B. C. Utilizing Transcranial Magnetic Stimulation to Study the Human Neuromuscular System. Journal of Visualized Experiments. (59), e3387 (2012).
- Sartori, L., Betti, S., Castiello, U. Corticospinal excitability modulation during action observation. Journal Of Visualized Experiments: Jove. (82), 51001 (2013).
- Rozand, V., Lebon, F., Papaxanthis, C., Lepers, R. Does a mental training session induce neuromuscular fatigue. Medicine and Science in Sports and Exercise. 46 (10), 1981-1989 (2014).
- Rozand, V., Cattagni, T., Theurel, J., Martin, A., Lepers, R. Neuromuscular fatigue following isometric contractions with similar torque time integral. International Journal of Sports Medicine. 36, 35-40 (2015).
- Belanger, A. Y., McComas, A. J. Extent of motor unit activation during effort. Journal of Applied Physiology. 51 (5), 1131-1135 (1981).
- Morse, C. I., Thom, J. M., Davis, M. G., Fox, K. R., Birch, K. M., Narici, M. V. Reduced plantarflexor specific torque in the elderly is associated with a lower activation capacity. European Journal of Applied Physiology. 92 (1-2), 219-226 (2004).
- Dalton, B. H., McNeil, C. J., Doherty, T. J., Rice, C. L. Age related reductions in the estimated numbers of motor units are minimal in the human soleus. Muscle and Nerve. 38 (3), 1108-1115 (2008).
- Hunter, S. K., Todd, G., Butler, J. E., Gandevia, S. C., Taylor, J. L. Recovery from supraspinal fatigue is slowed in old adults after fatiguing maximal isometric contractions. Journal of Applied Physiology. 105 (4), 1199-1209 (2008).
- Jakobi, J. M., Rice, C. L. Voluntary muscle activation varies with age and muscle group. Journal of Applied Physiology. 93 (2), 457-462 (2002).
- Lepers, R., Millet, G. Y., Maffiuletti, N. a Effect of cycling cadence on contractile and neural properties of knee extensors. Medicine and Science in Sports and Exercise. 33 (11), 1882-1888 (2001).
- Duchateau, J., Hainaut, K. Isometric or dynamic training differential effects on mechanical properties of a human muscle. Journal of Applied Physiology. 56 (2), 296-301 (1984).
- Millet, G. Y., Martin, V., Martin, A., Vergès, S. Electrical stimulation for testing neuromuscular function From sport to pathology. European Journal of Applied Physiology. 111, 2489-2500 (2011).
- Cattagni, T., Scaglioni, G., Laroche, D., Van Hoecke, J., Gremeaux, V., Martin, A. Ankle muscle strength discriminates fallers from non fallers. Frontiers in Aging Neuroscience. 6, 336 (2014).
- Horstman, A. M., Beltman, M. J., et al. Intrinsic muscle strength and voluntary activation of both lower limbs and functional performance after stroke. Clinical Physiology and Functional Imaging. 28 (4), 251-261 (2008).
- Sica, R. E., Herskovits, E., Aguilera, N., Poch, G. An electrophysiological investigation of skeletal muscle in Parkinson’s disease. Journal of the Neurological Sciences. 18 (4), 411-420 (1973).
- Knikou, M., Mummidisetty, C. K. Locomotor Training Improves Premotoneuronal Control after Chronic Spinal Cord Injury. Journal of Neurophysiology. 111 (11), 2264-2275 (2014).

