Katı Lipit nanopartiküller (SLNs) Hücre içi Hedefleme için başvurular
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
Nanoparçacık tabanlı dağıtım araçları, özellikle hücresel sinyalizasyon ve gen ifadesini değiştirmek için bir mekanizma sağlayarak, hücre içi hedefleme uygulamalar için büyük umut göstermiştir. Bu araçlar, ilaç, proteinler, hem de hücresel yanıtları etkileyecek ve hedef dokularda arzu edilen bir etkiyi elde etmek için tasarlanmış bir nükleik asit ile yüklenebilir. Nanocarriers birçok tipi lipidler, polimerler, silisyum ve manyetik malzemeler de dahil olmak üzere terapötik ve diagnostik yararı için incelenmiştir. Bu sistemler bir terapötik hedef dokularda konsantrasyonu, ve sistemik toksisite azalmasına sebep lokalize ilaç dağıtımı için potansiyeli, için çekicidir.
Katı lipid nanoparçacıklarının (SLNs) son yıllarda umut verici bir ilaç verme vasıtası olarak ortaya çıkan bir nanopartikül verme sisteminin iyi çalışılmış örnektir. SLNs hali hazırda biyo-algılayıcı 1, kozmetik 2 ve t de dahil olmak üzere çok sayıda uygulama için formüle edilebilirherapeutic teslimat 3-7. Onların yarar onlar gelişmiş biyouyumluluk sonuçlanan emilebilir, toksik olmayan lipitlerin tamamen oluşmaktadır gerçeğinden kaynaklanmaktadır. Sentez sırasında, lipofilik ilaçlar böylece parenteral uygulama için ilacın çözünürlüğünü ve uygunluğu, artan SLN araç içine dahil edilebilir. SLN araçlar aynı zamanda bozulması ve açıklığını azaltarak ve terapötik etkisini maksimize kapsüllü terapötikler stabilize etmek için yardımcı olur. Bu araçlar sayesinde vücut sıcaklığı 3,4,8,9 de stabiliteleri özellikle uzun etkili, kontrollü salım preparasyonlar için uygundur. Önemli olarak, lipid nanoparçacıklarının ilaç kapsülleme ilaç moleküllerin içsel farmakokinetik profiller değiştirir. Bu dar bir terapötik indeksi olan ilaçların kontrollü bir salınıma izin veren, bir potansiyel bir avantaj sağlar. SLN-dahil terapötik salım hızı ayarlanmış lipid bozunum hızı ya da ilaç yayılma hızına dayalı olabilirlipit matris.
SLNs genellikle belirli hedef dokularda birikir tasarlanmıştır. Örneğin, kendi boyutu (tipik olarak daha fazla 10 nm), tümör dokusunun sızdıran damar birikimi kolaylaştıran dolaşım içinde tutma güçlendirir. Buna ek olarak, partikül uygulama yolu gibi lenf düğümleri 10,11 gibi özel fizyolojik yapılar hedef potansiyeli olan bir biyo dağılıma değiştirmek için gösterilmiştir. Hedef dokularda birikimi, uygun hücresel etkileşimi sağlamak ve nanopartiküllerin nihai bunun üzerine bağlı seçici hücre içine ve 12 üzerinden iyon ve moleküllerin akışını kontrol etmek için hücre zarlarının yeteneği nedeniyle zordur. Hücresel alımı kolaylaştırmak için, peptidler, küçük moleküller, ve monoklonal antikorlar da dahil olmak üzere 13,14 spesifik ligandlarla nanocarriers değiştirmek mümkündür. Pasif penetrasyon ve nanopartiküllerin aktif ulaşım de dahil olmak çeşitli mekanizmalarhücre zarı boyunca, daha önce 3,12,15 tarif edilmiştir. Genel olarak, bu, hücre-nanopartikül etkileşimleri, hücre tipi veya hücre döngüsü faz 12 olarak hücreye özel parametrelere ek olarak, boyut, şekil, yüzey yükü ve yüzey kimyası da dahil olmak üzere nanopartiküller fizikokimyasal özellikleri tarafından etkilendiği gösterilmiştir.
Bir önceki soruşturma aşaması inversiyon sıcaklığı (PIT) yöntemini kullanarak 17 16 topikal ve biyomarker algılama uygulamaları 1 için alt 10 nm SLNs sentezini gösterdi. Bu sıcaklık yavaş yavaş değişir ise bileşimi aynı kalır 2 hafif bir sentez yöntemidir. Isıtılmış çözeltinin sürekli karıştırma, gibi nanoemülziyon RT sonuçlarına soğur. Daha küçük bir partikül boyutuna sahip 1 SLNs sentezinde Bu işlem, daha önce sonuçlar lipid nan sentezi için çeşitli yöntemler kullanılarak raporoparticles 17-22. Elde edilen boyut ölçeği, en az 20 nm, artan yüzey alanı ve gelişmiş bir hücresel etkileşimler için potansiyeli, hücre içi hedef uygulamalar için avantaj sağlamaktadır.
Bir floresan boya veya terapötik sağlamak üzere tasarlanmıştır SLNs şematik, Şekil 1 'de gösterilmiştir. SLNs bir lipit iç (örneğin, lineer alkan) lipofilik bileşiklerin (örneğin, boyalar veya terapötik) dahil edilmesine izin veren ve bir yüzey aktif dış oluşmaktadır su ile çevrili (örneğin, doğrusal noniyonik yüzey aktif madde). Bu çalışmada, SLNs bir floresan boya ile yüklenir ve partikül-hücre etkileşimleri incelemek için bir model olarak kullanılmıştır. Primer insanlara özgü dermal fibroblastlar ve fare dendritik hücreler toksisite ve parçacık alımı ile ilgili etkileşimler karakterize etmek amacıyla zaman SLN yüklü boyamaktadır maruz bırakıldı. A: 3- (4,5-dimetiltiazol-2-il) -2,5-diphenylphenyltetrazolium bromid (MTT) deneyi utili olduUygun doz seviyelerinin kurmak amacıyla zed. Floresan mikroskobu ve akım sitometri in vitro parçacık alımını incelemek için kullanılan iki yöntem vardı.
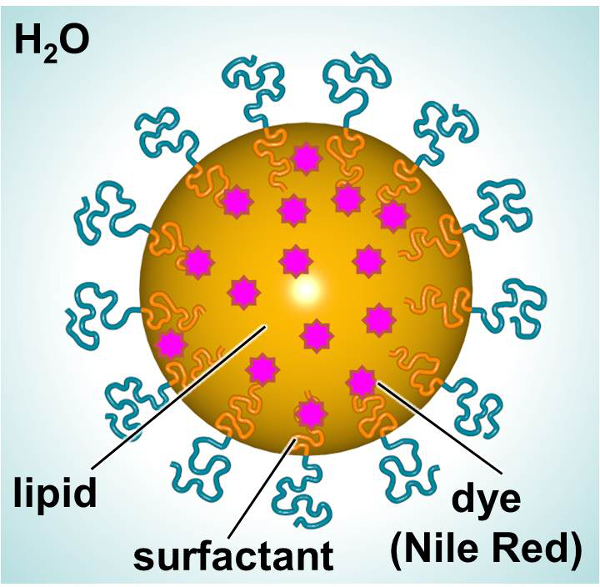
Önemli bileşenlerini gösteren SLN Şekil 1. şematik. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protocol
Representative Results
Discussion
Bu çalışmada, SLNs sentezi ve hücre içi uygulamalar için hedefleme uygulanabilirlikleri incelenmiştir. Bu biyouyumlu nanopartiküller ilaç dağıtımı, gen susturma ve aşı teknolojilerine 25-30 olmak üzere birden fazla uygulama için dağıtım araçları olarak söz göstermiştir. Ultra küçük SLNs bir uyduruk işlemi kullanılarak sentezlendi ve primer deri hücreleri ve primer immün hücreleri ile etkileşimleri incelenmiştir. SLNs model terapötik kargo olarak görev yapan bir floresan bo…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
Riferimenti
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

