Dynamisk elektrokemisk mätning av kloridjoner
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
En kloridjon sensor baserad på övergångstiden mätning av en Ag / AgCl-elektrod presenteras. Syftet är att undvika de inneboende drivor under den långsiktiga kontinuerlig övervakning av kloridjoner i elektrolyten. Chronopotentiometric mätning, som är en dynamisk mätning tillvägagångssätt, av en Ag / AgCl-elektrod används för detta ändamål. Här en ändringshastighet av potentialen hos en Ag / AgCl-elektrod mäts under en stimulus (galvanostatisk puls). Fördelen med detta tillvägagångssätt framgår av undkommer vätska-korsning referenselektrod och istället använda någon metalltråd som en pseudoreferenselektrod, därför tillåter detektion av Cl-joner koncentrationen för långsiktiga (år) och i applikationer situ, såsom mätning inuti betongkonstruktioner.
Kloridjoner i betongkonstruktioner är en av de främsta orsakerna till 1,2 nedbrytning. Det initierar punktfrätning i armeringen stålet ennd resultat i den slutliga misslyckande strukturen 3. Därför mäter Cl-joner i betong är oundvikligt att förutsäga livslängden och underhållscykel av en struktur 4,5. Olika sensorprinciper har rapporterats för kloridjoner mätning i betong såsom elektro 6,7, optisk 8,9 och elektromagnetiska 10,11. Men optiska och elektromagnetiska metoder har skrymmande uppställningar, är svåra att integrera som ett fristående system och har problem med selektivitet 12. I elektrokemisk teknik, är potentiometrisk mätning av en Ag / AgCl elektroden toppmoderna strategi 6,7,13. Trots lovande resultat, är denna metod begränsad till laboratorieskala mätning eftersom drivorna i referensspänning och diffusion spänningsfall resulterar i felaktiga uppgifter 14,15. En övergångstiden strategi som bygger på den dynamiska elektrokemiska mätningen (DEM) kunde lindra problem på grund av potentiellaglida 16.
I DEM, är ett systems svar på en applicerad stimulus mäts 17-19. Exemplet med ett sådant system är kronopotentiometri. Här en pålagd strömpuls används som en stimulus nedbrytande joner nära elektrodytan och den motsvarande potentiella respons mäts. En anodströmmen på en Ag / AgCl-elektrod initierar en faradisk reaktion (Ag + Cl 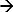 AgCl + e) vilket resulterar i en utarmning av Cl-joner nära elektrodytan. Den potentiella förändringen är en funktion av den pålagda strömmen och koncentrationen av de (selektiva) joner i elektrolyten 12,20. Det ögonblick dessa joner bryter helt nära elektrodytan ändringshastigheten av potentiella stiger snabbt, vilket ger en inflexionspunkt 21. Inflektionspunkten på svarskurvan potentialtiden (chronopotentiogram) visar tids övergång och kan bestämmas frånmaximum av den första derivatan av den potentiella svaret 22. Övergångstiden är ett kännetecken för jonkoncentrationen. Denna metod har använts för att bestämma olika joner koncentration 17 och pH av elektrolyter 23,24. I händelse av en Ag / AgCl-elektrod som en arbetselektrod (till vilken ström matas) den tilländalöpande jonerna kommer att vara kloridjoner 17. Därför mäta dess övergångstiden kommer att bestämma dess koncentration.
AgCl + e) vilket resulterar i en utarmning av Cl-joner nära elektrodytan. Den potentiella förändringen är en funktion av den pålagda strömmen och koncentrationen av de (selektiva) joner i elektrolyten 12,20. Det ögonblick dessa joner bryter helt nära elektrodytan ändringshastigheten av potentiella stiger snabbt, vilket ger en inflexionspunkt 21. Inflektionspunkten på svarskurvan potentialtiden (chronopotentiogram) visar tids övergång och kan bestämmas frånmaximum av den första derivatan av den potentiella svaret 22. Övergångstiden är ett kännetecken för jonkoncentrationen. Denna metod har använts för att bestämma olika joner koncentration 17 och pH av elektrolyter 23,24. I händelse av en Ag / AgCl-elektrod som en arbetselektrod (till vilken ström matas) den tilländalöpande jonerna kommer att vara kloridjoner 17. Därför mäta dess övergångstiden kommer att bestämma dess koncentration.
Protocol
Representative Results
Discussion
Övergångstiden är tidpunkten för böjnings; det är teoretiskt oberoende av referenspotentialen dvs referenselektroden. Därför varje metalltråd kan användas som en pseudoreferenselektrod för mätning övergångstids. I motsats till den befintliga potentiometrisk mätning av kloridjoner i betong denna metod möjliggör en långsiktig och kalibrering fri mätning. Vidare kan avstämmas känsligheten och detekteringen koncentrationsområdet genom att justera den pålagda strömpulsen. För högre Cl-konce…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
Riferimenti
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

