झिल्ली परिवहन एकल प्रोटीन संकल्प पर एक अत्यधिक समानांतर nanopore चिप सिस्टम द्वारा विश्लेषण प्रक्रियाओं
Summary
The presented protocol describes the analysis of membrane protein mediated transport on the single transporter level using pore-spanning solvent-free lipid bilayers. This is achieved by the creation of bulk produced nanopore array chips, combined with highly parallel data acquisition and analysis, enabling the future establishment of membrane protein effector screenings.
Abstract
झिल्ली एकल प्रोटीन के स्तर पर प्रोटीन परिवहन अभी भी विस्तृत विश्लेषण बचाव किया, अगर सब्सट्रेट translocated गैर electrogenic है। काफी प्रयास इस क्षेत्र में किया गया है, लेकिन विलायक मुक्त लिपिड bilayer झिल्ली ट्रांसपोर्टरों के विश्लेषण के लिए आवश्यक तकनीक के साथ संयोजन में स्वचालित उच्च throughput परिवहन विश्लेषण को सक्षम करने की तकनीक दुर्लभ हैं। ट्रांसपोर्टरों का यह वर्ग हालांकि सेल homeostasis में महत्वपूर्ण है और इसलिए दवा के विकास और तरीकों नए अंतर्दृष्टि हासिल करने के लिए एक महत्वपूर्ण लक्ष्य की सख्त जरूरत है।
यहाँ प्रस्तुत पांडुलिपि एक ट्रांसपोर्टर के प्रस्ताव पर झिल्ली प्रोटीन की मध्यस्थता परिवहन प्रक्रियाओं के विश्लेषण के लिए स्थापना और एक उपन्यास biochip की हैंडलिंग का वर्णन है। biochip nanopores कि इसकी डिजाइन में अत्यधिक समानांतर है और औद्योगिक ग्रेड और मात्रा में उत्पादन किया जा सकता से घिरा microcavities से बना है। प्रोटीन शरण liposomes सीधे लागू किया जा सकताचिप सतह आत्म इकट्ठे ताकना फैले लिपिड का उपयोग कर एसएसएम तकनीक bilayers गठन (ठोस लिपिड झिल्ली समर्थित)। ताकना फैले झिल्ली के कुछ हिस्सों, freestanding रहे हैं में या गुहा जगह है, जो वास्तविक समय में मल्टी स्पेक्ट्रल फ्लोरोसेंट readout द्वारा पीछा किया जा सकता से बाहर सब्सट्रेट translocation के लिए इंटरफेस प्रदान करते हैं। मानक संचालन प्रक्रिया (एसओपी) की स्थापना के लगभग हर झिल्ली प्रोटीन की चिप सतह कि कार्यात्मक पुनर्गठन किया जा सकता है प्रोटीन को शरण देने लिपिड bilayers का सीधा स्थापना की अनुमति देता है। एकमात्र शर्त गैर electrogenic परिवहन substrates के लिए एक फ्लोरोसेंट पढ़ने के लिए बाहर प्रणाली की स्थापना है।
उच्च सामग्री स्क्रीनिंग अनुप्रयोगों स्वचालित औंधा फ्लोरोसेंट समानांतर में कई चिप्स रिकॉर्डिंग माइक्रोस्कोप के इस्तेमाल से accomplishable हैं। बड़े डेटा सेट आसानी से उपलब्ध कस्टम डिजाइन विश्लेषण सॉफ्टवेयर का उपयोग विश्लेषण किया जा सकता है। तीन रंग बहु वर्णक्रमीय फ्लोरोसेंटपढ़ने के लिए बाहर इसके अलावा झूठी सकारात्मक परिणाम को नष्ट करने, विभिन्न वर्गों में घटना निष्पक्ष डेटा भेदभाव के लिए अनुमति देता है।
चिप प्रौद्योगिकी वर्तमान में 2 Sio सतहों आधारित है, लेकिन सोने में लिपटे चिप सतहों का उपयोग करते हुए आगे functionalization भी संभव है।
Introduction
झिल्ली प्रोटीन के विश्लेषण के पिछले 20 वर्षों में बुनियादी और दवा अनुसंधान के लिए ब्याज में वृद्धि का बन गया है। उपन्यास दवाओं के विकास की पहचान और नए लक्ष्य की विस्तृत लक्षण वर्णन, वर्तमान में सीमित कारकों में से एक होने पर निर्भर करता है। तथ्य यह है कि सभी दवा लक्ष्यों के बारे में 60% झिल्ली प्रोटीन कर रहे हैं 1, तकनीक के विकास के उनके कार्य सबसे महत्वपूर्ण स्पष्ट करने के लिए बनाता है।
4 – अतीत में, electrogenic चैनलों और ट्रांसपोर्टरों के अध्ययन के लिए तकनीक भीड़ 2 में विकसित किया गया है। इसके विपरीत में गैर-electrogenic substrates एक अधिक चुनौतीपूर्ण कार्य प्रस्तुत करते हैं। वे प्रधानमंत्री दवा लक्ष्य के रूप में विशेष रुचि के हैं, लेकिन के रूप में वे झरने 5 संकेत में विलेय और कोशिका झिल्ली और समारोह में मुख्य रिसेप्टर्स के रूप में सामने पोषक तत्वों के प्रवाह को नियंत्रित।
काफी प्रयास टी के विकास में डाल दिया गया हैechniques झिल्ली परिवहन प्रोटीन 6, 7 के समारोह में अध्ययन करने के लिए। 10, ठोस समर्थित लिपिड bilayers, सीमित bilayers 11, 12, microblack लिपिड झिल्ली 13, 14 और देशी पुटिका सरणियों 15, 16 के लिए कुछ नाम सहित – ठोस समर्थित झिल्ली सिस्टम का उपयोग कर इस क्षेत्र में 8 के रूप में सबसे होनहार उपकरण में उभरा है। उनमें से कुछ वाणिज्यिक setups 17, 18 के रूप में भी उपलब्ध हैं। कुछ उदाहरण एक अत्यधिक समानांतर तरीके से 14, 19, स्क्रीनिंग अनुप्रयोगों के लिए एक शर्त में एक झिल्ली प्रोटीन का अध्ययन करने की क्षमता के संयोजन प्रकाशित किया गया है। हालांकि, इन तरीकों को शायद ही कभी औद्योगिक वातावरण के लिए बुनियादी अनुसंधान से पुल। कठिनाइयों अक्सर प्रणाली की क्षमता automatable होने के लिए, लागत गहन उत्पादन और / या श्रमसाध्य तैयारी में झूठ बोलते हैं। एक दृष्टिकोण ओउपर्युक्त सभी बाधाओं vercoming अंतिम उद्देश्य है।
22 – यहाँ प्रस्तुत तकनीक एकल प्रोटीन के स्तर 20 पर एक नियंत्रित वातावरण में इन विट्रो में झिल्ली चैनलों और ट्रांसपोर्टरों अध्ययन करने के लिए विकसित किया गया था। 26 या काले लिपिड झिल्ली 27 – LUVs में शुद्ध झिल्ली प्रोटीन के पुनर्गठन और अधिक GUVs 23 के लिए तुलनीय दृष्टिकोण से भी स्थापना की है। वे सीधे चिप सतह, जहां bilayer गठन एक आत्म विधानसभा की प्रक्रिया के माध्यम से जगह ले जा रहा है के लिए लागू किया जा सकता है। Nanoporous चिप (छवि। 1) के गिलास नीचे डिजाइन हवा माइक्रोस्कोपी, जो प्रणाली का सीधा स्वचालन परमिट के लिए अनुमति देता है। एक मोटर चालित मंच के साथ संयोजन में कई चिप्स के विश्लेषण के लिए सील कर दिया गुहाओं के हजारों युक्त देखने के प्रत्येक क्षेत्र के साथ एक ही समय में मापा जा सकता है।
<p class="jove_content" fo:keep-together.within-page= "1">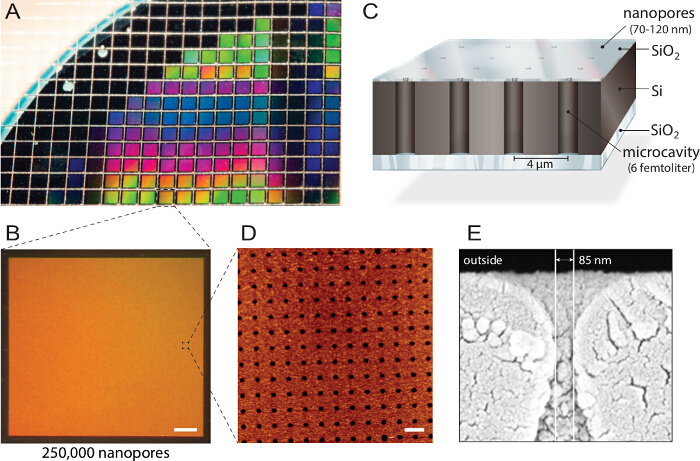
चित्रा 1। मल्टिप्लेक्स nanopore biochips के डिजाइन। ए) एक सिलिकॉन पर इन्सुलेटर (एसओआई) वेफर प्रतिक्रियाशील आयन नक़्क़ाशी द्वारा संरचित है। लगभग 1,150 व्यक्तिगत चिप्स समान गुण और गुणवत्ता। ख) प्रत्येक चिप नैनो apertures के साथ 250,000 व्यक्ति microcavities शामिल हैं के साथ प्रत्येक मे से गढ़े हैं। स्केल पट्टी:। 200 माइक्रोन सी) प्रत्येक गुहा मल्टी स्पेक्ट्रल प्रतिदीप्ति पढ़ने के लिए बाहर के माध्यम से पता है। एक intransparent ऊपर परत ब्लॉकों बफर जलाशय से फ्लोरोसेंट संकेत है, biochip औंधा प्रतिदीप्ति सूक्ष्मदर्शी। डी) परमाणु शक्ति माइक्रोस्कोपी के साथ संगत बनाने (AFM) इमेजिंग समान रूप से ध्यान में लीन होना उद्घाटन और 3.6 एनएम के सिलिकॉन डाइऑक्साइड परत की सतह खुरदरापन की व्यवस्था की पता चलता है (एन = 40) पुटिका संलयन के लिए इष्टतम। स्केल पट्टी:। 5 माइक्रोन ई) स्कैनिंग इलेक्ट्रॉन microscopy (SEM) छवि nanopore सिलिकॉन चिप के अंदर femtoliter cavities के लिए उपयोग की अनुमति के माध्यम से एक पार अनुभाग से पता चलता है। यह आंकड़ा 21 से अनुमति के साथ पुन: उपयोग किया गया था। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
सभी डेटा विश्लेषण अंत उपयोगकर्ताओं के लिए अप्रतिबंधित पहुँच गारंटी करने के लिए फ्रीवेयर का उपयोग किया जाता है। समय श्रृंखला मुक्त इमेज प्रोसेसिंग सॉफ्टवेयर और एक कस्टम निर्माण वक्र विश्लेषण सॉफ्टवेयर को सक्रिय करने के बैच प्रसंस्करण और कई फ्लोरोसेंट चैनलों और घटता के हजारों के साथ बड़े डेटासेट का सीधा सह-संबंध का उपयोग विश्लेषण कर रहे हैं।
मॉडल इस प्रोटोकॉल में इस्तेमाल प्रोटीन बड़े चालकता (MSCL) चैनल प्रोटीन की mechanosensitive चैनल ई से प्राप्त होता है कोलाई। यह एक वाल्व प्रकृति में आसमाटिक सदमे को रिहा करने के रूप में कार्य करता है, लेकिन इस तरह है कि तर्क से SYNT डिजाइन में संशोधित किया गया थाhetic कार्यक्षमताओं covalently चैनलों कसना पक्ष से जुड़ा जा सकता है। के माध्यम से covalently बाध्य उत्प्रेरक (MTSET) चैनल खोलने के लिए शुरू हो रहा है के आरोप प्रतिकर्षण, एक नैनो वाल्व बनाने। आयनों, पानी, छोटे प्रोटीन, लेकिन यह भी छोटे fluorophores की तरह छोटे अणुओं चैनल के माध्यम से तर कर सकते हैं। इधर, प्रोटीन प्रोटीन की मध्यस्थता translocation का पता लगाने के लिए इस प्रणाली की क्षमता का प्रदर्शन करने के लिए एक मॉडल के रूप में प्रयोग किया जाता है।
Protocol
Representative Results
Discussion
यहाँ प्रस्तुत तकनीक झिल्ली प्रोटीन परिवहन की एक अत्यधिक समानांतर विश्लेषण की अनुमति देता है। पुनर्गठन झिल्ली प्रोटीन सिस्टम सीधे सैद्धांतिक रूप से हर झिल्ली ट्रांसपोर्टर का रूपांतरण कर रही है या स?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We thank Barbara Windschiegl for her help in establishing SOPs; Dennis Remme for his work on the NanoCalcFX software and Alina Kollmannsperger, Markus Braner and Milan Gerovac for helpful suggestions on the manuscript. The German-Israeli Project Cooperation (DIP) provided by the DFG and the Federal Ministry of Education and Research to R.T., as well as the Federal Ministry of Economics and Technology (ZIM R&D Project) to R.T. and Nanospot GmbH supported this work.
Materials
| Reagent | |||
| [2-(Trimethylammonium)ethyl] methanethiosulfonate |
Toronto Research Chemicals Inc. | T792900 | MTSET; hydrolized by water. Keep as dry pouder aliquot at -80 °C. Use immediately (30 minutes) after solubilization in buffer. |
| 1 ml gas-tight syringe | Hamilton | #1001 | |
| 10 ml round flask | Schott Duran | ||
| 2.7 mm glas beads | Roth | N032.1 | |
| 2-Propanole | Roth | 9866.5 | |
| 30 cm Luer-Lock Extension Tube | Sarstedt | 744304 | |
| Acetone | Roth | 5025.5 | |
| Bio-Beads SM-2 Adsorbent | Bio-Rad | 152-3920 | need to be activated before first use |
| CaCl2 Dihydrat | Roth | HN04.3 | |
| Calcein | Sigma | C0875 | store dark at -20 °C |
| Chloroform reagent grade | VWR Chemicals | 22711324 | |
| DOPEATTO390 | ATTO-TEC | AD 390-165 | store dark at -20 °C |
| Ethanol absolute | Sigma-Aldrich | 32205 | |
| Injekt Single-use syringe | Braun | 460 60 51V | |
| Injekt-F single-use syringe | Braun | 91 66 017V | |
| Keck clips | Schott | KC29 | |
| L-α-Phosphatidylcholine, 20% (Soy) | Avanti Polar Lipids | 5416016 | store under inert gas at -20 °C |
| NaCl 99.5% p.a. | Roth | 3957.2 | |
| Nanopore E100 wafer/chips | Micromotive (Mainz/Germany) | available on request | |
| Nucleopore Track-Etch Membrane 0.4 µm | Whatman | 800282 | |
| Oregon Green Dextran 488 (70 kDa) | life Technologies | D-7173 | store dark at -20 °C |
| Oy647 | Luminartis (Münster/Germany) | OY-647-T-1mg | store dark at -20 °C |
| Rotilabo-syringe filtration, unsterile, pore-size 0.22 µm | Roth | P 818.1 | |
| Sephadex G-50 | Sigma-Aldrich | G5080 | column material for size exclusion chromatography |
| Silastic MDX4-4210 | Dow Corning | curing agent for chip fixation onto cover glass support | |
| sticky-Slide 8-well | ibidi | 80828 | multi-well chamber for the mounting onto glass slides (chip holder) |
| Three-way stopcock blue | Sarstedt | 744410001 | |
| Tris Pufferan 99.9% Ultra Quality | Roth | 5429.2 | |
| Triton-X 100 | Roth | 6683.1 | |
| Whatman 0.2 µm cellulose nitrate membrane filter | Roth | NH69.1 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Büchi 461 water bath | Büchi | ||
| Büchi Rotavapor RE 111 | Büchi | ||
| Cary Eclipse Fluorescence Spectrophtometer | Varian | ||
| LiposoFast Mini Extruder | Avestin | ||
| Membrane pump | Vaccubrand | 15430 | |
| Nanosight Nanoparticle Tracking Microscope | Malvern / Nanosight | LM 14C | |
| NyONE microscope | Synentec | available on request | |
| Pump control | Vaccubrand | CVC 2II | |
| Sonicator bath Sonorex RK100H | Brandelin electronic | 31200001107477 | |
| Vaccum pump RC5 | Vaccubrand | 1805400204 | |
| Water bath W13 | Haake | 002-9910 | |
| Plasma Cleaner PDC-37G | Harrick Plasma | PDC-37G | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| ImageJ | Open Source | http://imagej.nih.gov/ij/ | scientific image processing software |
| NanoCalcFX | Freeware | http://sourceforge.net/projects/nanocalc/ | data analysis/evaluation software for massive transport kinetic datasets |
| NTA 2.3 Analytical Software | Nanosight | data acquisition and analysis software for nanoparticle tracking microscope | |
| NTA 2.3 Temperature Comms | Nanosight | temperature controle software for nanoparticle tracking microscope |
Riferimenti
- Yildirim, M. A., Goh, K. I., Cusick, M. E., Barabasi, A. L., Vidal, M. Drug-target network. Nat Biotechnol. 25, 1119 (2007).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391, 85-100 (1981).
- Osaki, T., Suzuki, H., Le Pioufle, B., Takeuchi, S. Multichannel simultaneous measurements of single-molecule translocation in α-hemolysin nanopore array. Anal. Chem. 81, 9866-9870 (2009).
- Carrillo, L., et al. High-resolution membrane capacitance measurements for studying endocytosis and exocytosis in yeast. Traffic. , (2015).
- Giacomini, K. M., et al. Membrane transporters in drug development. Nat. Rev. Drug Discov. 9, 215-236 (2010).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angew. Chem. Int. Ed. 51, 3134-3138 (2012).
- Zollmann, T., et al. Single liposome analysis of peptide translocation by the ABC transporter TAPL. Proc. Natl. Acad. Sci. U.S.A. 112, 2046-2051 (2015).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys. J. 47, 105-113 (1985).
- Sackmann, E. Supported membranes: scientific and practical applications. Science. 271, 43-48 (1996).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surf. Sci. Rep. 61, 429-444 (2006).
- Wagner, M. L., Tamm, L. K. Tethered polymer-supported planar lipid bilayers for reconstitution of integral membrane proteins: silane-polyethyleneglycol-lipid as a cushion and covalent linker. Biophys. J. 79, 1400-1414 (2000).
- Naumann, C. A., et al. The polymer-supported phospholipid bilayer: tethering as a new approach to substrate-membrane stabilization. Biomacromolecules. 3, 27-35 (2002).
- Weiskopf, D., Schmitt, E. K., Klühr, M. H., Dertinger, S. K., Steinem, C. Micro-BLMs on highly ordered porous silicon substrates: Rupture process and lateral mobility. Langmuir. 23, 9134-9139 (2007).
- Watanabe, R., et al. Arrayed lipid bilayer chambers allow single-molecule analysis of membrane transporter activity. Nat. Commun. 5, (2014).
- Stamou, D., Duschl, C., Delamarche, E., Vogel, H. Self-Assembled Microarrays of Attoliter Molecular Vessels. Angew. Chem. Int. Ed. 115, 5738-5741 (2003).
- Lohr, C., et al. Single Liposomes Used to Study the Activity of Individual Transporters. Biophysical Journal. 106, 229a (2014).
- Dunlop, J., Bowlby, M., Peri, R., Vasilyev, D., Arias, R. High-throughput electrophysiology: an emerging paradigm for ion-channel screening and physiology. Nat. Rev. Drug Discov. 7, 358-368 (2008).
- Milligan, C. J., et al. Robotic multiwell planar patch-clamp for native and primary mammalian cells. Nat. Protoc. 4, 244-255 (2009).
- Soga, N., Watanabe, R., Noji, H. Attolitre-sized lipid bilayer chamber array for rapid detection of single transporters. Sci. Rep. 5, (2015).
- Kleefen, A., et al. Multiplexed parallel single transport recordings on nanopore arrays. Nano Lett. 10, 5080-5087 (2010).
- Wei, R., Gatterdam, V., Wieneke, R., Tampé, R., Rant, U. Stochastic sensing of proteins with receptor-modified solid-state nanopores. Nat. Nanotechnol. 7, 257-263 (2012).
- Urban, M., et al. Highly parallel transport recordings on a membrane-on-nanopore chip at single molecule resolution. Nano Lett. 14, 1674-1680 (2014).
- Kusters, I., Van Oijen, A. M., Driessen, A. J. Membrane-on-a-Chip: Microstructured Silicon/Silicon-Dioxide Chips for High-Throughput Screening of Membrane Transport and Viral Membrane Fusion. ACS Nano. 8, 3380-3392 (2014).
- Hansen, J. S., Thompson, J. R., Hélix-Nielsen, C., Malmstadt, N. Lipid directed intrinsic membrane protein segregation. J. Am. Chem. Soc. 135, 17294-17297 (2013).
- Heinemann, F., Schwille, P. Preparation of Micrometer-Sized Free-Standing Membranes. ChemPhysChem. 12, 2568-2571 (2011).
- Lazzara, T. D., Carnarius, C., Kocun, M., Janshoff, A., Steinem, C. Separating attoliter-sized compartments using fluid pore-spanning lipid bilayers. ACS nano. 5, 6935-6944 (2011).
- Winterhalter, M. Black lipid membranes. Curr. Opin. Colloid Interface Sci. 5, 250-255 (2000).
- Koçer, A., Walko, M., Feringa, B. L. Synthesis and utilization of reversible and irreversible light-activated nanovalves derived from the channel protein MscL. Nat. Protoc. 2, 1426-1437 (2007).

