Opløsning Dynamic Nuclear Polarisering Instrumentation for Real-time enzymatisk reaktion Rate Målinger ved NMR
Summary
The sensitivity enhancement provided by dissolution dynamic nuclear polarization (DNP) enables following metabolic processes in real time by NMR and MRI. The characteristics and performances of a dedicated dissolution DNP setup designed for study enzymatic reactions are discussed.
Abstract
Den væsentligste begrænsning af NMR-baserede undersøgelser er lav følsomhed. Dette beder for lange erhvervelsestider, hvilket forhindrer realtid NMR målinger af metaboliske transformationer. Hyperpolarisering via opløsning DNP omgår en del af følsomheden udsteder takket være det store out-of-balance nuklear magnetisering som følge af spin polarisering overførsel elektron-til-kerne. Den høje NMR signal, der opnås, kan anvendes til at overvåge kemiske reaktioner i realtid. Ulempen af hyperpolariseret NMR bosat i den begrænsede tid vindue til rådighed for signal erhvervelse, som normalt er på rækkefølgen af den nukleare spin-langsgående relaksationstidskonstant, T 1, eller, i gunstige tilfælde, om rækkefølgen af relaksationstidskonstant forbundet med singlet-tilstand af koblede kerner, T LLS. Cellulær optagelse af endogene molekyler og stofskifte kan give væsentlige oplysninger om tumor udvikling og lægemiddelrespons. Numerous tidligere hyperpolariserede NMR-undersøgelser har vist relevansen af pyruvat som en metabolisk substrat til overvågning enzymatisk aktivitet in vivo. Dette arbejde giver en detaljeret beskrivelse af forsøgsopstillingen og metoder kræves for studiet af enzymatiske reaktioner, især omregningskursen pyruvat-til-laktat i tilstedeværelse af laktat dehydrogenase (LDH), ved hyperpolariseret NMR.
Introduction
Dynamisk nukleare polarisering (DNP), 1,2 en teknik designet til at forbedre den nukleare spin-polarisering, dvs. ubalancen mellem "op" og "ned" spin-populationer (P = [N ↑ – N ↓] / [N ↑ + N ↓]), blev først indført i 1950'erne. Nuclear spins såsom 13C kan polariseret op til P = 10 -1 i gunstige betingelser, typisk ved en temperatur på i størrelsesordenen 1 K og i et magnetfelt på 3,357 T. 3,4 Et gennembrud for biologiske anvendelser kom i tidligt 2000'erne med udviklingen af opløsning DNP, der består i at opløse frosne polariserede prøver i overhedet vand samtidig bevare den høje kernepolarisation niveau opnået ved lav temperatur. 5 væsken-NMR-signalet forstærkes med en faktor 10 3 -10 4 sammenlignet med fællestermisk polariseret RT NMR betingelser. Opløsning DNP tilvejebringer derfor en måde til ikke-invasivt måler biokemiske reaktionshastigheder in situ i realtime, så overvågning dynamik ved NMR med en tidsmæssig opløsning på 1 sek eller mindre 6 -. 10 blev det også muligt at detektere analytter i meget lave koncentrationer 11.
Blandt de ikke-invasive molekylære afbildningsmodaliteter, hyperpolariserede NMR er den eneste teknik, der giver samtidig måling af et substrat og dets metabolitter i realtid. Opløsning DNP blev modtaget med begejstring i forskellige videnskabelige områder lige fra in vitro-NMR til klinisk MRI 12 og de mest lovende programmer er relateret til in situ overvågning af stofskiftet. 13,14 Den væsentligste begrænsning af opløsning DNP er, at efter en tid på størrelsesordenen fem gange den langsgående relaksationstidskonstant T 1, den forbedrede polæreization er tabt. Det er derfor nødvendigt at anvende molekyler bærer kernespin udviser forholdsvis lang T 1. For at forlænge tidsrum af polarisering ekstraudstyr, langsomt-afslappende nukleare spin-tilstande, der er kendt som langlivede tilstande (LLS), kan der anvendes 15 -. 17 LLS er ufølsomme over for den intra-pair dipol-dipol interaktion, så deres karakteristisk relaksationstidskonstant, T LLS, kan være meget længere end T1. 18 A magnetisering levetid ti minutter og op til 1 time kunne derfor opnås, 19,20 og er blevet foreslået LLS for både magnetisk resonans spektroskopi (MRS) og MR. 21
De vigtigste punkter, der skal være omhyggeligt optimeret til at studere enzymatiske reaktionshastigheder ved hyperpolariseret NMR er: (i) maksimere solid state polarisering og (ii) minimere polarisering tab under overførslen af den hyperpolariserede opløsningen frapolarisator til NMR spektrometer. Denne artikel beskriver en tilpasning af et skræddersyet opløsning DNP apparater og indsprøjtningssystem til at studere enzymatiske reaktioner. De karakteristika og ydeevne opsætningen vil blive demonstreret med den velkendte og udbredte hyperpolariseret substrat [1- 13 C] pyruvat. De vigtigste årsager til dette valg er, første, dens naturligt lange 13C langsgående afslapning tid (T 1> 50 sek ved høje magnetfelter og temperaturer over 293 K), der tillader overvågning reaktioner under flere minutter, og for det andet, sin centrale rolle i cancer metabolisme. 13,14 Anvendelse opløsning DNP NMR og en brugerdefineret udviklede indsprøjtningssystem, oxidationen af pyruvat katalyseret af lactatdehydrogenase (LDH) kan overvåges i nærvær af en første pool af umærket lactat 9,22 eller uden umærket lactat tilsat som vist her. Det har vist sig, at [1- 13 C] laktat signal målt i vivo (herunder celler) efter injektion af hyperpolariseret [1- 13C] pyruvat skyldes hovedsagelig en hurtig etiket udveksling mellem pyruvat og lactat frem til lactat produktion. 6
Heri præsentere realtid produktion af [1- 13C] lactat fra hyperpolariseret [1- 13C] pyruvat indsprøjtes i en NMR-rør indeholdende LDH men oprindeligt ingen lactat.
Systembeskrivelse
Der er to primære dele i en opløsning DNP setup (figur 1): DNP polarisator og NMR spektrometer. Det vigtigste element i DNP polarisator er en kryostat til afkøling af prøven til omkring 1 K i en pumpet helium bad. Kryostaten er indsat i et 3,35 T superledende magnet og har en geometri, der garanterer at have den polariserende prøve ved isocentret af magneten (figur 1). Inde i kryostat, prøven (a) er omgivet af en NMR-spole (b), for at måle polarisationen Buildup, indeholdt i en oversvingningstilstande mikrobølgehulrum (c). Hele prøven holdes ved lav temperatur i et pumpet helium bad (d) og bestrålet med mikrobølger gennem bølgelederen. Hele systemet styres af skræddersyet software (figur 2D).
Hardwaren og kuldeudstyr nødvendig for at udføre DNP og den efterfølgende opløsning er stadig en teknologisk udfordring. En ny DNP kryostaten 23,24 blev udviklet og testet for at bestemme dens kryogene forestillinger og derefter optimeret til hurtig nedkøling, helium hold-tid og den samlede minimale helium forbrug under drift.
Kryostaten består af to dele. Den første del af kryostaten er isoleringen dewar (figur 2A), som groft kan adskilles i øverste del (a) halen, eller prøve rum (b), og den ydre vakuumkammer (OVC) holdt under højvakuum og huser stråling skærme (c). Den anden del af kryostaten er det vigtigste isert (figur 2B), placeres i isoleringen dewar, hvor alle flow regler administreres. Den flydende helium kommer fra eksternt dewar-karret gennem overførsel linje (a), er i det første trin kondenseres i separatoren (b), et mellemliggende kammer bruges både til at holde den øverste del af kryostaten kolde og fjerne helium inddampet under overførslen. Separatoren tryk sænkes ved at pumpe gennem et kapillarrør (c) viklet rundt om øverste del af kryostaten; strømmen af kold helium i denne kapillær anvendes til at køle ned baflerne (d) og strålingen skærme i isoleringen dewar (OVC). Prøven anbringes og polariseret i udfaldsrummet. Prøven rum er forbundet til separatoren gennem en anden kapillær (e), viklet omkring halen af den primære kryostat insert. Denne kapillær kan åbnes eller lukkes via en nåleventil manuelt betjent udefra.
For at opnå den lave temperatur, der anvendes under DNP process, behov flydende helium, der skal indsamles i kryostat udfaldsrummet og dens tryk sænkes til den mbar rækkevidde. Operationerne er nødvendige for kryostat operation udføres gennem en temmelig kompleks pumpesystem med tre sæt pumper, overvåges og drives i forskellige punkter med elektroniske og elektro-mekaniker instrumenter (Figur 2C). Kryostaten OVC skal pumpes til højvakuum ved den første pumpesystemet. Dette system er sammensat af en turbo-molekylær pumpe bakkes op af en roterende pumpe (a). Den flydende helium overføres fra lageret dewar (b) gennem kryostaten overføringsledning indløb til kryostat separator. Separatoren har et udløb forbundet med den anden pumpe sæt. Dette sæt består af en 35 m 3 / time membranpumpe (c). Denne linje giver fjerne helium gas kogt under overførslen fra Dewar og under separator køling. Den flydende helium opsamlet i separatoren kan derefter overføres til prøven rum gennem hættenIllary rør beskrevet ovenfor. For at overføre flydende helium fra separatoren til prøven plads og efterfølgende lavere udfaldsrum pres for at mbar rækkevidde, en tredje pumpesystem, der består af en 250 m 3 / t Roots pumpe bakkes op af en 65 m 3 / t roterende pumpe (d) er forbundet til kryostaten gennem en manuel butterflyventil (e).
Alle vakuum system operationer styres og reguleres af en elektropneumatisk skræddersyet enhed (f). Denne enhed styrer vakuum ledningsforbindelser mellem kryostaten separator (g) og prøve rum (h) forretninger, de anden / tredje pumpesystemer (c, d), en komprimeret helium flaske (i) og ydersiden. Kommunikation mellem (f) og ydersiden passerer gennem en envejsventil (j). Den elektro-pneumatiske enhed (f), samt alle systemparametre og opløsningen hardware styres og drives af en skræddersyet elektronisk enhed interface USB med en fælles pc. Endelig hele systemet, via den elektroniskeenhed, administreres af skræddersyet standalone software (figur 2D), hvor relevante operationer lanceres via en grænseflade ved hjælp af software-knapper.
For at styre prøven og måle NMR signal ophobning i fast tilstand anvendes en række indsatser (figur 3A). For at forberede kryostaten for polarisering, placere hovedstikprøven indsatsen (a), i kryostaten. Hovedstikprøven indsatsen er forsynet med en NMR-spole (b) anbragt inde i en oversvingningstilstande guldbelagt mikrobølgehulrum. Pre-freeze underlaget opløsning skal polariseret (polariserende opløsning) ved flydende nitrogen temperatur i et passende udvalg beholder og placere den i slutningen bunden af holderen glasfiber prøve (c). Skub holderen prøven i den vigtigste prøve indsatsen for at nå magneten isocentret. Sæt guldbelagte bølgeleder (d) i prøveholderen. Den bølgeleder giver mikrobølgeovnen genereret fra en ekstern mikrobølge kilde til at rejse med minimal tab to prøven.
Den skræddersyede software til kryostat styring håndterer automatisk ved klikke på den tilsvarende grænseflade knappen, forskellige operationer som nedkøling (kryostaten temperaturen sænkes tæt på flydende helium temperatur), udfyldning (kryostaten er fyldt med flydende helium til en forudbestemt niveau ), et yderligere trin med afkøling til T ≈ 1 K (den flydende helium bad pumpes for at opnå den lavest mulige temperatur), tryksætning (kryostaten sættes under tryk lidt over atmosfæretryk ved P = 10-30 mbar for at tillade kryostat åbning uden risici for kontaminering af kryostaten med fly) og opløsning (automatisk procedure til opløsning af DNP prøven og overføre den resulterende hyperpolariserede løsning på målestedet, dvs. NMR spektrometer).
Polariseringen udføres bestråling af prøven med mikrobølger ved 94 GHz (i en polariserende felt B 0 </sub> = 3,35 T). En prøve betragtes fuldstændigt polariseret efter 3 T DNP, hvor T DNP er polariseringen oprustning tid. T DNP er af samme størrelsesorden som den langsgående relaksationstid af målet kerner i fast tilstand på det givne felt og temperatur. I alle vores eksperimenter blev prøven polariseret mere end 5 T DNP.
Ved afslutningen af polarisationen tid, prøven skal opløses i en RT opløsning for at blive anvendt til måling af enzymatisk aktivitet. Under opløsningsprocessen, er 5 ml overhedet D2O fra kedlen for opløsningen insertet (figur 3B) skubbet af komprimeret heliumgas (P = 6-8 bar) for at nå den DNP-forstærket prøve og opløse den. Den resulterende hyperpolariserede opløsning skubbes ud opløsningen indsatsen ved den komprimerede heliumgas, gennem opløsning insert udløb den (figur 3C-b </sTrong>), en 2 mm indvendig diameter Teflon overføringsrøret. Den nødvendige til opløsning procestiden er 300 ms. 23 nødvendige tid til prøven overførsel fra DNP polarisator til NMR spektrometer site handler om 3 sek.
Opløsningsprocessen udføres under anvendelse af en opløsning insert (figur 3B). Opløsningen indsatsen er sammensat af et elektronisk-pneumatisk konstruktion (a), en kulfiber stick (b) indeholder forbindelsesrør mellem kedlen i den pneumatiske montage og prøvebeholderen locker (c), som tillader læk-tæt kobling med prøven beholder, og tilbage ud til udløbet. Den elektro-pneumatisk montage (figur 3C) anvendes til at fremstille og drive overhedet D2O gennem kulfiber stick til prøvebeholderen og derefter at ekstrahere den hyperpolariserede løsning fra kryostaten. Den elektro-pneumatisk montage er sammensat af pneumatiske ventiler (a), der kontrollerer forbindelserne mellem compressed helium (P = 6-8 bar) linje (b), kedlen (c) når D2O indsprøjtes gennem ventilen (d), og udløbet (e) gennem kulfiber stick (f). Systemet fuldendes af et tryk G, et termometer og en opvarmning resistiv wire i kedlen (c), en udløser (h) og en tilslutningsboks (i) anvendes til at interface systemet med den elektroniske styring enheden.
DNP kryostaten og NMR-spektrometer er forbundet med en overføringsledning, dvs en PTFE-røret på 2 mm indre diameter, inden i hvilket den hyperpolariserede opløsning skubbes af tryksat helium (P = 6-8 bar), når opløsningen er udløst.
Opløsningen sekvens består af følgende operationer: i de første 300 msek, overhedet D2O skubbes til prøven beholder for at smelte og opløse den hyperpolariserede frosne opløsning. Bagefter hyperpolariserede opløsning ekstraheret fra kryostaten ved gennemsnit af pressurized (P = 6-8 bar) helium gas og skubbet gennem 2 mm indvendig diameter PTFE rør (figur 3C-e) til målestedet, hvor injektionen udføres med en af de procedurer, der er beskrevet i trin 6.2.1 eller Trin 6.2 0,2.
Den anden komponent i opløsningen DNP NMR opsætning er NMR-spektrometer. I opsætningen heri beskrevne NMR-spektrometer arbejder ved et felt B 0 = 11,7 Tesla. En 5 mm NMR probe anvendes til at måle den hyperpolariserede signal efter opløsningen. NMR-spektrometer betjenes via NMR-konsollen, der anvendes til både solid-state og væske-state NMR-målinger, og firmaet-medfølgende software XWinNMR. En typisk måling består af en lav flipvinkel hårdt puls (enten kalibreret, for liquidstate eller un-kalibreret, for solid-state målinger) efterfulgt af opkøb signal.
Målinger af den faste tilstand termiske polarisationssignal og DNP-afledt signal opbygning udføres ved hjælp af skræddersyet 13C spole på stedet af DNP polarisator (figur 3AB) koblet til NMR spektrometer. I denne særlige situation er NMR-spektrometer ikke udføre signal låsning. Når solid-state målinger foretages, for at undgå væsentlige forstyrrelser til polarisering, bør tidsforsinkelsen mellem anskaffelser være lang nok, groft længere end 0,5 T DNP.
Den solid state ekstraudstyr er defineret som 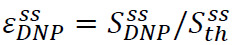 hvor
hvor ![]() er den hyperpolariserede signal (opnået i trin 3.3) og
er den hyperpolariserede signal (opnået i trin 3.3) og ![]() er fast tilstand signal (opnået ved termisk ligevægt ved pumpet flydende helium temperatur i trin 3.2) (figur 4A). Denne parameter defines den maksimale polarisation rådighed for NMR eksperimenter, før uundgåelige tab i overførslen af den hyperpolariserede opløsning. Målingen udføres med en simpel puls-erhverve sekvens under anvendelse af et ikke-kalibreret lav flipvinkel puls. Pulse kalibrering er almindeligt springes til solidstate målinger.
er fast tilstand signal (opnået ved termisk ligevægt ved pumpet flydende helium temperatur i trin 3.2) (figur 4A). Denne parameter defines den maksimale polarisation rådighed for NMR eksperimenter, før uundgåelige tab i overførslen af den hyperpolariserede opløsning. Målingen udføres med en simpel puls-erhverve sekvens under anvendelse af et ikke-kalibreret lav flipvinkel puls. Pulse kalibrering er almindeligt springes til solidstate målinger.
En analog fremgangsmåde kan anvendes til at bestemme den hyperpolariserede forstærkning af signalet væske-tilstand. I dette tilfælde placeres prøven i spektrometret røret før injektionen (trin 6.2) bestående af 500 pi D 2 O. Efter opløsning og injektion, er der to vigtige parametre til at overvåge. Den første er den hyperpolariseret forbedring på NMR-spektrometer site, 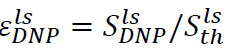 (Figur 4B), hvor
(Figur 4B), hvor ![]() er det signal lige efter injektionen af hyper polariseret opløsning (opnået i trin 7.1) og
er det signal lige efter injektionen af hyper polariseret opløsning (opnået i trin 7.1) og ![]() er den termiske polarisationssignal (opnået i trin 7.2). Den anden er den langsgående relaksationstid, T 1 (figur 4B, indsat), der er forbundet med substratet, og hver metabolisk produkt (opnået ved eksponentiel montering signaler opnået i trin 7.1). Disse to parametre definerer den minimale substratkoncentration nødvendig for at opnå en tilstrækkelig signal-til-støj-forhold (SNR) og den tilgængelige tidsvindue til måling af de metaboliske transformationer. Forholdet mellem solid state polarisering
er den termiske polarisationssignal (opnået i trin 7.2). Den anden er den langsgående relaksationstid, T 1 (figur 4B, indsat), der er forbundet med substratet, og hver metabolisk produkt (opnået ved eksponentiel montering signaler opnået i trin 7.1). Disse to parametre definerer den minimale substratkoncentration nødvendig for at opnå en tilstrækkelig signal-til-støj-forhold (SNR) og den tilgængelige tidsvindue til måling af de metaboliske transformationer. Forholdet mellem solid state polarisering ![]() og liquidstate polarisering
og liquidstate polarisering ![]() giver et skøn over de tab polarisering skyldes afslapning under den hyperpolariserede løsning overførsel. En værdiation12 "src =" / files / ftp_upload / 53548 / 53548equation12.jpg "width =" 80 "skal overholdes /> i fravær af tab afslapning.
giver et skøn over de tab polarisering skyldes afslapning under den hyperpolariserede løsning overførsel. En værdiation12 "src =" / files / ftp_upload / 53548 / 53548equation12.jpg "width =" 80 "skal overholdes /> i fravær af tab afslapning.
Protocol
Representative Results
Discussion
De kritiske punkter i opløsningen DNP NMR eksperiment er: (i) størrelsen af polarisation opnået for substratet, der bestemmer den laveste produktkoncentration nødvendig for eksperimenter samt antallet af signalpunkter erhvervelser, der kan udføres, og (ii) levetider af magnetisering, sammenlignet med varigheden af overførslen mellem polarisering og afsløring steder og til hastigheden af substrat transformation. Indsprøjtningssystemet af opløsningen DNP opsætning beskrevet heri muliggør prøv…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker Dr. JJ van der Klink for bistand i valg og montering af udstyret, samt Dr. F. Kateb og Dr. G. Bertho for nyttige diskussioner. AC blev støttet af den schweiziske National Science Foundation (give PPOOP2_157547). Vi anerkender finansiering fra Paris Sorbonne Cité (NMR @ Com, DIM Analytics, Ville de Paris, Fondation de la Recherche Médicale (FRM ING20130526708), og Parteneriat Hubert Curien Brancusi 32662QK. Vores team er en del af Equipex programmer Paris-en-Resonans og CACSICE.
Materials
| DNP polarizer | Vanderklink s.a.r.l (Switzerland) | /// | Cryostat and electronic equipment for sample polarization |
| Vacuum system components | Edwards vacuum (France) | Various |
– turbomolecular pumping setup – membrane pumping setup – high capacity roots pumping system – vacuum fittings and components |
| DNP 3.35T Magnet | Bruker (France) | ||
| 500MHz NMR Spectrometer | Bruker (France) | ||
| Origin 8.0 | OriginLab (US) | Data analysis software | |
| Chemicals | |||
| SODIUM PYRUVATE-1-13C, 99 ATOM % 13C | Sigma Aldrich (France) | 490709 | |
| ETHANOL-D6, ANHYDROUS, 99.5 ATOM % D | Sigma Aldrich (France) | 186414 | |
| 4-Hydroxy-TEMPO 97% | Sigma Aldrich (France) | 176141 | |
| Deuterium oxide | Sigma Aldrich (France) | 151882 | |
| reduced nicotinamide adenine dinucleotide (NADH) | Sigma Aldrich (France) | ||
| ethylene-diaminetetraacetic acid (EDTA) | Sigma Aldrich (France) | ||
| dithiothreitol (DTT) | Sigma Aldrich (France) | ||
| phosphate buffer, pH = 7.0 | Sigma Aldrich (France) | ||
| LDH enzyme in | Sigma Aldrich (France) | L-2500 | |
| bovine serum albumin, BSA | Sigma Aldrich (France) |
Riferimenti
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Abragam, A., Goldman, M. Principles of dynamic nuclear polarisation. Rep. Prog. Phys. 41 (3), 395 (1978).
- Wolber, J., Ellner, F., et al. Generating highly polarized nuclear spins in solution using dynamic nuclear polarization. Nuc. Inst. Met. Phys. Res. Sec. A. 526 (1-2), 173-181 (2004).
- Cheng, T., Capozzi, A., Takado, Y., Balzan, R., Comment, A. Over 35% liquid-state 13C polarization obtained via dissolution dynamic nuclear polarization at 7 T and 1 K using ubiquitous nitroxyl radicals. PCCP. 15 (48), 20819-20822 (2013).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. PNAS. 100 (18), 10158-10163 (2003).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Keshari, K. R., Wilson, D. M., et al. Hyperpolarized [2-13C]-Fructose: A Hemiketal DNP Substrate for In Vivo Metabolic Imaging. JACS. 131 (48), 17591-17596 (2009).
- Zeng, H., Lee, Y., Hilty, C. Quantitative Rate Determination by Dynamic Nuclear Polarization Enhanced NMR of a Diels−Alder Reaction. An. Chem. 82 (21), 8897-8902 (2010).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13C NMR. NMR in Biom. 25 (11), 1286-1294 (2012).
- Allouche-Arnon, H., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. In vitro visualization of betaine aldehyde synthesis and oxidation using hyperpolarized magnetic resonance spectroscopy. Chem. Comm. 49 (63), 7076-7078 (2013).
- Lerche, M. H., Meier, S., et al. Quantitative dynamic nuclear polarization-NMR on blood plasma for assays of drug metabolism. NMR in Biom. 24 (1), 96-103 (2011).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Trans. Med. 5 (198), 198ra108 (2013).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of Cancer Metabolism by Imaging Hyperpolarized Nuclei: Prospects for Translation to Clinical Research. Neoplasia. 13 (2), 81-97 (2011).
- Comment, A., Merritt, M. E. Hyperpolarized Magnetic Resonance as a Sensitive Detector of Metabolic Function. Biochem. 53 (47), 7333-7357 (2014).
- Carravetta, M., Johannessen, O. G., Levitt, M. H. Beyond the T-1 limit: Singlet nuclear spin states in low magnetic fields. PRL. 92 (15), 153003 (2004).
- Carravetta, M., Levitt, M. H. Theory of long-lived nuclear spin states in solution nuclear magnetic resonance. I. Singlet states in low magnetic field. J. Chem. Phys. 122 (21), 214505 (2005).
- Vasos, P. R., Comment, A., et al. Long-lived states to sustain hyperpolarized magnetization. PNAS. 106 (44), 18469-18473 (2009).
- Claytor, K., Theis, T., Feng, Y., Warren, W. Measuring long-lived 13C2 state lifetimes at natural abundance. JMR. 239, 81-86 (2014).
- Pileio, G., Carravetta, M., Hughes, E., Levitt, M. H. The long-lived nuclear singlet state of N-15-nitrous oxide in solution. JACS. 130 (38), 12582-12583 (2008).
- Stevanato, G., Hill-Cousins, J. T., et al. A Nuclear Singlet Lifetime of More than One Hour in Room-Temperature Solution. Ange. Chem. Int. Ed. 54 (12), 3740-3743 (2015).
- Ghosh, R. K., Kadlecek, S. J., et al. Measurements of the Persistent Singlet State of N(2)O in Blood and Other Solvents-Potential as a Magnetic Tracer. MRM. 66 (4), 1177-1180 (2011).
- Harris, T., Eliyahu, G., Frydman, L., Degani, H. Kinetics of hyperpolarized 13C1-pyruvate transport and metabolism in living human breast cancer cells. PNAS. 106 (43), 18131-18136 (2009).
- Comment, A., van den Brandt, B., et al. Design and performance of a DNP prepolarizer coupled to a rodent MRI scanner. Conc. Mag. Res. B. 31 (4), 255-269 (2007).
- Balzan, R. . Methods for Molecular Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy using Hyperpolarized Nuclei. 5966, 1-140 (2013).
- Bornet, A., Melzi, R., et al. Boosting Dissolution Dynamic Nuclear Polarization by Cross Polarization. JPC Letters. 4 (1), 111-114 (2013).
- Bowen, S., Hilty, C. Rapid sample injection for hyperpolarized NMR spectroscopy. PCCP. 12 (22), 5766-5770 (2010).
- Cavadini, S., Vasos, P. R. Singlet states open the way to longer time-scales in the measurement of diffusion by NMR spectroscopy. Conc. Mag. Res. A. 32 (1), 68-78 (2008).
- Ahuja, P., Sarkar, R., Vasos, P. R., Bodenhausen, G. Long-lived States in Multiple-Spin Systems. Chem. Phys. Chem. 10 (13), 2217-2220 (2009).
- Ahuja, P., Sarkar, R., Jannin, S., Vasos, P. R., Bodenhausen, G. Proton hyperpolarisation preserved in long-lived states. Chem. Comm. 46 (43), 8192-8194 (2010).
- Sarkar, R., Comment, A., et al. Proton NMR of 15N-Choline Metabolites Enhanced by Dynamic Nuclear Polarization. JACS. 131 (44), 16014-16015 (2009).

