יצירת CRISPR / Cas9 מתווכת Monoallelic מחיקות ללמוד לתפקד Enhancer בתאי עכבר גזע עובריים
Summary
Experimental validation of enhancer activity is best approached by loss-of-function analysis. Presented here is an efficient protocol that uses CRISPR/Cas9 mediated deletion to study allele-specific regulation of gene transcription in F1 ES cells which contain a hybrid genome (Mus musculus129 x Mus castaneus).
Abstract
Enhancers control cell identity by regulating tissue-specific gene expression in a position and orientation independent manner. These enhancers are often located distally from the regulated gene in intergenic regions or even within the body of another gene. The position independent nature of enhancer activity makes it difficult to match enhancers with the genes they regulate. Deletion of an enhancer region provides direct evidence for enhancer activity and is the gold standard to reveal an enhancer’s role in endogenous gene transcription. Conventional homologous recombination based deletion methods have been surpassed by recent advances in genome editing technology which enable rapid and precisely located changes to the genomes of numerous model organisms. CRISPR/Cas9 mediated genome editing can be used to manipulate the genome in many cell types and organisms rapidly and cost effectively, due to the ease with which Cas9 can be targeted to the genome by a guide RNA from a bespoke expression plasmid. Homozygous deletion of essential gene regulatory elements might lead to lethality or alter cellular phenotype whereas monoallelic deletion of transcriptional enhancers allows for the study of cis-regulation of gene expression without this confounding issue. Presented here is a protocol for CRISPR/Cas9 mediated deletion in F1 mouse embryonic stem (ES) cells (Mus musculus129 x Mus castaneus). Monoallelic deletion, screening and expression analysis is facilitated by single nucleotide polymorphisms (SNP) between the two alleles which occur on average every 125 bp in these cells.
Introduction
גורמי רגולטוריים תעתיק הם קריטיים עבור כוונון במרחב ובזמן קנס של ביטוי גנים במהלך התפתחות 1 ושינוי של אלמנטים אלו יכולים לגרום למחלות בשל ביטוי 2 גנים סוטים. אזורים רבים הקשורים מחלה שזוהו על ידי מחקרי עמותה רחבים הגנום נמצאים באזורים ללא קידוד ויש להם תכונות של משפרי תעתיק 3-4. זיהוי משפר והתאמתי עם הגנים שהם מווסתים מסובכים כפי שהם בדרך כלל ממוקמים כמה kilobases מן הגנים שהם מווסתים ועשויים להיות מופעלים באופן רקמות ספציפיות 5-6. תחזיות Enhancer מבוססים בדרך כלל על סימני שינוי היסטון, מתחמי-cohesin מתווך ומחייבת של שעתוק סוג תא ספציפי גורמי 7-10. אימות של משפר חזוי לרוב נעשתה באמצעות assay וקטוריות שבו משפרים מפעיל ביטוי של גן כתב 11-12. נתונים אלה מספקים נמידע aluable מהפוטנציאל רגולטוריות של רצפים משפרים משוערים אבל לא חושף את תפקידם בהקשר הגנומי אנדוגני שלהם או לזהות את הגנים שהם מווסתים. הגנום עריכה משמש ככלי רב עוצמה כדי לחקור את הפונקציה של גורמים רגולטוריים תעתיק בהקשר אנדוגני שלהם על ידי ניתוח הפסד של פונקציה.
התקדמות עריכת הגנום, כלומר מערכת עריכת הגנום CRISPR / Cas9, לסייע בחקירת פונקציה הגנום. מערכת CRISPR / Cas9 קלה לשימוש להתאמה למערכות ביולוגיות רבות. החלבון Cas9 הוא ממוקד לאתר מסוים בגנום ידי RNA מדריך (gRNA) 13. המתחם SpCas9 / gRNA סורק את הגנום רצף גנומי היעד שלה אשר חייב להיות 5 'כדי מוטיב הסמוך protospacer (PAM) רצף, NGG 14-15. זיווג מאגר של gRNA למטרתה, 20 נוקלאוטידים (NT) רצף משלים gRNA, יפעיל פעילות nuclease SpCas9 וכתוצאה מכך doublדואר גדיל Break (DSB) 3 נ"ב במעלה הזרם של רצף PAM. סגולי מושג באמצעות זיווג בסיס שלם באזור הזרע gRNA, 6-12 nt סמוך PAM; לעומת זאת, חוסר התאמה 5 'של הזרע בדרך כלל נסבלים 16-17. הציג DSB ניתן לתיקון או עד הסוף שאינו הומולוגי שהצטרף (NHEJ) תיקון דנ"א או תיקון מכוון הומולוגיה (HDR) תיקון דנ"א mechanisms.NHEJ יוצר לעתים קרובות כניסה / מחיקה (indels) של כמה נ"ב באתר היעד שיכול לשבש מסגרת הקריאה הפתוחה (ORF) של גן. כדי ליצור מחיקות גדולות בגנום שני gRNAs, אשר לאגף את האזור של עניין, ניתן להשתמש 18-19. גישה זו שימושית במיוחד עבור המחקר של משפרי תעתיק התקבצו לאזורים מלאי לוקוס או-משפרי סופר אשר שגודלם עולים על משפר קונבנציונלי 9,18,20-22.
מחיקות Monoallelic הם מודל ערך ללימוד -regulation cis של שעתוק. הנצפה צ'אנגדואר ברמת תמליל לאחר מחיקת monoallelic של משפר וקושר לתפקיד משפר כי ויסות גנים ללא תופעות הבלבול שעלול להתרחש כאשר שעתוק של שני אללים מושפע ההשפיע כושר הסלולר פוטנציאלי. הערכת ביטוי מופחת קשה אולם ללא היכולת להבחין בין נמחק מן אלל הסוג הבר. יתר על כן, genotyping מחיקות בכל אלל ללא היכולת להבחין בין שני אללים הוא מאתגר, במיוחד עבור מחיקות גדולות של> 10 kb עד 1 Mb 23 שבו קשה להגביר את האזור סוג בר כולו על ידי PCR. השימוש בתאי גזע עובריים F1 שנוצר על ידי מעבר Mus musculus 129 עם Mus castaneus מאפשר שני אללים כדי להיות מובחן על ידי אלל ספציפי PCR 18,24. הגנום ההיברידי בתאים אלו, מסייע הקרנה מחיקה ספציפית אלל וניתוח ביטוי. בממוצע יש SNP כל נ"ב 125 בין שני אלה הגנוםמתן, גמישות בעיצוב פריימר לביטוי גנוטיפ מנתח. הנוכחות של SNP אחד יכול להשפיע על טמפרטורת ההתכה פריימר (מ T), ולמקד סגוליות PCR כמותי בזמן אמת (qPCR) הגברה המאפשר אפליה של שני אללים 25. יתר על כן חוסר התאמה בתוך הסוף '3 של פריימר משפיעה מאוד על היכולת של DNA פולימרז להאריך מן פריימר למנוע הגברה של יעד אלל הרצוי 26. כמתואר בפרוטוקול הבא הוא השימוש בתאי גזע עוברי F1 עבור מחיקות משפרות ספציפית אלל של יותר מ 1 kb וניתוח ביטוי שלאחר מכן באמצעות מערכת עריכת הגנום CRISPR / Cas9 (איור 1).
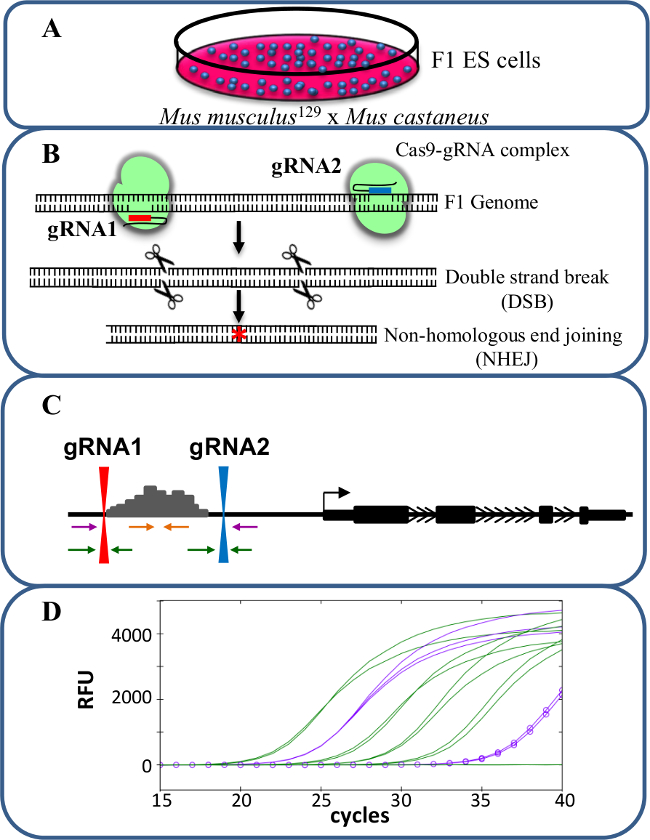
איור 1. מחיקת Enhancer באמצעות CRISPR / Cas9 ללמוד ציס -regulation של ביטוי גנים. (א) בתאי גזע עובריים F1 שנוצר על ידי הכלאה בין Mus musculus 129 Mus castaneus משמשים כדי לאפשר למחיקה ספציפית אלל. (ב) שני RNAs המדריך (gRNA) משמש כדי לעורר מחיקת Cas9 בתיווך גדולה של האזור משפר. (ג) קובע פריימר ומשמשים לזיהוי מונו גדול ומחיקות דו-אללים. פריימרים הכתומים הם פריימרים בפנים, פריימרים הסגול הם פריימרים מחוץ ואת פריימרים הירוקים הם פריימרים איגוף gRNA. (ד) שינויים בביטוי הגנים מנוטרים באמצעות qPCR אלל ספציפי. RFU מציין יחידות קרינה יחסיות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
עריכת טכנולוגיה הגנום בתיווך CRISPR / Cas9 מספק שיטה פשוטה, מהירה וזולה עבור שינוי הגנום. השיטה המפורטת כאן כדי ליצור ולנתח מחיקה משפר monoallelic לאפיון משפר תפקודי מנצלת SNPs בתאי עכבר F1. היתרונות של סוג זה של גישה הם: 1) מחיקות משפרים monoallelic אינן מייצרות תופעות בלבול המתרחשות כאש…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to thank all the members of the Mitchell lab for helpful discussions. This work was supported by the Canadian Institutes of Health Research, the Canada Foundation for Innovation and the Ontario Ministry of Research and Innovation (operating and infrastructure grants held by JAM).
Materials
| Phusion High-Fidelity DNA Polymerase | NEB | M0530S | high fidelity DNA polymerase used in gRNA assembly |
| Gibson Assembly Master Mix | NEB | E2611L | |
| gRNA_Cloning Vector | Addgene | 41824 | A target sequence is cloned into this vector to create the gRNA plasmid |
| pCas9_GFP | Addgene | 44719 | Codon-optimized SpCas9 and EGFP co-expression plasmid |
| AflII | NEB | R0520S | |
| EcoRI | NEB | R3101S | |
| Neon Transfection System 100 µL Kit | Life Technologies | MPK10096 | Microporator transfection technology |
| prepGEM | ZyGEM | PT10500 | genomic DNA extraction reagent |
| Nucleo Spin Gel & PCR Clean-up | Macherey-Nagel | 740609.5 | |
| High-Speed Plasmid Mini Kit | Geneaid | PD300 | |
| Maxi Plasmid Kit Endotoxin Free | Geneaid | PME25 | |
| SYBR select mix for CFX | Life Technologies | 4472942 | qPCR reagent |
| iScript cDNA synthesis kit | Bio-rad | 170-8891 | Reverse transcription reagent |
| 0.25% Trypsin with EDTA | Life Technologies | 25200072 | |
| PBS without Ca/Mg2+ | Sigma | D8537 | |
| 0.5M EDTA | Bioshop | EDT111.500 | |
| HBSS | Life Technologies | 14175095 | |
| 1M HEPES | Life Technologies | 13630080 | |
| BSA fraction V (7.5%) | Life Technologies | 15260037 | |
| Max Efficiency DH5α competent cells | Invitrogen | 18258012 | |
| FBS | ES cell qualified | FBS is subjected to a prior testing in mouse ES cells for pluripotency | |
| DMSO | Sigma | D2650 | |
| Glutamax | Invitrogen | 35050 | |
| DMEM | Life Technologies | 11960069 | |
| Pencillin/Streptomycin | Invitrogen | 15140 | |
| Sodium pyruvate | Invitrogen | 11360 | |
| Non-essential aminoacid | Invitrogen | 11140 | |
| β-mercaptoethanol | Sigma | M7522 | |
| 96-well plate | Sarstedt | 83.3924 | |
| Sealing tape | Sarstedt | 95.1994 | |
| CoolCell LX | Biocision | BCS-405 | alcohol-free cell freezing container |
| CHIR99021 | Biovision | 1748-5 | Inhibitor for F1 ES cell culture |
| PD0325901 | Invivogen | inh-pd32 | Inhibitor for F1 ES cell culture |
| LIF | Chemicon | ESG1107 | Inhibitor for F1 ES cell culture |
Riferimenti
- Sagai, T., Hosoya, M., Mizushina, Y., Tamura, M., Shiroishi, T. Elimination of a long-range cis-regulatory module causes complete loss of limb-specific Shh expression and truncation of the mouse limb. Development. 132 (4), 797-803 (2005).
- Kleinjan, D. A., Lettice, L. A. Long-range gene control and genetic disease. Adv Genet. 61, 339-388 (2008).
- Visel, A., Rubin, E. M., Pennacchio, L. A. Genomic views of distant-acting enhancers. Nature. 461 (7261), 199-205 (2009).
- Maurano, M. T., et al. Systematic localization of common disease-associated variation in regulatory DNA. Science. 337 (6099), 1190-1195 (2012).
- Heintzman, N. D., et al. Histone modifications at human enhancers reflect global cell-type-specific gene expression. Nature. 459 (7243), 108-112 (2009).
- Shen, Y., et al. A map of the cis-regulatory sequences in the mouse genome. Nature. 488 (7409), 116-120 (2012).
- Johnson, D. S., Mortazavi, A., Myers, R. M., Wold, B. Genome-wide mapping of in vivo protein-DNA interactions. Science. 316 (5830), 1497-1502 (2007).
- Rhee, H. S., Pugh, B. F. Comprehensive genome-wide protein-DNA interactions detected at single-nucleotide resolution. Cell. 147 (6), 1408-1419 (2011).
- Whyte, W. A., et al. Master transcription factors and mediator establish super-enhancers at key cell identity genes. Cell. 153 (2), 307-319 (2013).
- Chen, C. Y., Morris, Q., Mitchell, J. A. Enhancer identification in mouse embryonic stem cells using integrative modeling of chromatin and genomic features. BMC Genomics. 13 (1), 152 (2012).
- Patwardhan, R. P., et al. Massively parallel functional dissection of mammalian enhancers in vivo. Nat Biotechnol. 30 (3), 265-270 (2012).
- Melnikov, A., et al. Systematic dissection and optimization of inducible enhancers in human cells using a massively parallel reporter assay. Nat Biotechnol. 30 (3), 271-277 (2012).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Cho, S. W., et al. Analysis of off-target effects of CRISPR/Cas-derived RNA-guided endonucleases and nickases. Genome Res. 24 (1), 132-141 (2014).
- Zhou, H. Y., et al. A Sox2 distal enhancer cluster regulates embryonic stem cell differentiation potential. Genes Dev. 28 (24), 2699-2711 (2014).
- Fujii, W., Kawasaki, K., Sugiura, K., Naito, K. Efficient generation of large-scale genome-modified mice using gRNA and CAS9 endonuclease. Nucleic Acids Res. 41 (20), e187 (2013).
- Tuan, D. Y., Solomon, W. B., London, I. M., Lee, D. P. An erythroid-specific, developmental-stage-independent enhancer far upstream of the human ‘beta-like globin’ genes. Proc Natl Acad Sci U S A. 86 (8), 2554-2558 (1989).
- Amano, T., et al. Chromosomal dynamics at the Shh locus: limb bud-specific differential regulation of competence and active transcription. Dev Cell. 16 (1), 47-57 (2009).
- Li, Y., et al. CRISPR reveals a distal super-enhancer required for Sox2 expression in mouse embryonic stem cells. PLoS One. 9 (12), e114485 (2014).
- Canver, M. C., et al. Characterization of genomic deletion efficiency mediated by clustered regularly interspaced palindromic repeats (CRISPR)/Cas9 nuclease system in mammalian cells. J Biol Chem. 289 (31), 21312-21324 (2014).
- Mlynarczyk-Evans, S., et al. X chromosomes alternate between two states prior to random X-inactivation. PLoS Biol. 4 (6), e159 (2006).
- Lefever, S., Pattyn, F., Hellemans, J., Vandesompele, J. Single-nucleotide polymorphisms and other mismatches reduce performance of quantitative PCR assays. Clin Chem. 59 (10), 1470-1480 (2013).
- Huang, M. M., Arnheim, N., Goodman, M. F. Extension of base mispairs by Taq DNA polymerase: implications for single nucleotide discrimination in PCR. Nucleic Acids Res. 20 (17), 4567-4573 (1992).
- Keane, T. M., et al. Mouse genomic variation and its effect on phenotypes and gene regulation. Nature. 477 (7364), 289-294 (2011).
- Yalcin, B., et al. Sequence-based characterization of structural variation in the mouse genome. Nature. 477 (7364), 326-329 (2011).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Gibson, D. G., Smith, H. O., Hutchison, C. A., Venter, J. C., Merryman, C. Chemical synthesis of the mouse mitochondrial genome. Nat Methods. 7 (11), 901-903 (2010).
- Ding, Q., et al. Enhanced efficiency of human pluripotent stem cell genome editing through replacing TALENs with CRISPRs. Cell Stem Cell. 12 (4), 393-394 (2013).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). J Vis Exp. (41), (2010).
- Forlenza, M., Kaiser, T., Savelkoul, H. F., Wiegertjes, G. F. The use of real-time quantitative PCR for the analysis of cytokine mRNA levels. Methods Mol Biol. 820, 7-23 (2012).
- Wu, J. H., Hong, P. Y., Liu, W. T. Quantitative effects of position and type of single mismatch on single base primer extension. J Microbiol Methods. 77 (3), 267-275 (2009).
- Sanyal, A., Lajoie, B. R., Jain, G., Dekker, J. The long-range interaction landscape of gene promoters. Nature. 489 (7414), 109-113 (2012).

