HPLC-basert analyse for å overvåke ekstracellulær nukleotid / Nukleosid- Metabolisme i Human kronisk lymfatisk leukemi celler
Summary
The protocol described here represents an easy and reproducible method that employs reverse phase high-performance liquid chromatography (RP-HPLC) to measure purine metabolism on chronic lymphocytic leukemia (CLL) cells cultured under different conditions.
Abstract
Denne fremgangsmåten beskriver en følsom, spesifikk og pålitelig og reproduserbar revers fase høy-ytelse væskekromatografi (RP-HPLC) analyse utviklet og validert for kvantifisering av ekstracellulære purinnukleotider og nukleosider produsert av renset kronisk lymfatisk leukemi (CLL) celler under forskjellige dyrkningsbetingelser . Kromatografisk separasjon av adenosin 5'-monofosfat (AMP), adenosin (ADO) og inosin (INO) utføres ved romtemperatur på en silika-basert reversert-fase-kolonne som brukes for polare forbindelse oppbevaring. Fremgangsmåten inkluderer en binær mobil fase, som består av 7 mM ammoniumacetat og acetonitril med en strømningshastighet på 1,00 ml / min. Eluatene blir overvåket ved bruk av en fotodiode-array UV-detektor innstilt på 260 nm. En standard kalibreringskurve generert for å beregne ligningen for den analytiske kvantifisering av hver purinforbindelse. Systemet kontroll, datainnsamling og analyse blir så utført. Bruk av denne protokollen, AMP, INO og ADO eluere på 7, 11 og 11,9 min, henholdsvis, og den samlede gangtid for hver prøve er 20 min. Denne protokollen kan påføres på forskjellige celletyper og cellelinjer (både fjæring og adherente), ved bruk av dyrkningsmedier som matrise. Fordelene er enkle og raske prøvepreparering og kravet om en liten mengde av supernatant for analyse. Videre er bruken av et serumfritt medium gjør det mulig å hoppe over proteinet utfellingstrinnet med acetonitril som påvirker den endelige konsentrasjonen av purin-forbindelser. En av begrensningene ved fremgangsmåten er kravet til likevektskolonnen kjøres før hver enkelt prøve løp, noe som gjør den totale driftstid på eksperimentet lengre og forhindrer høy gjennomstrømning screeningsprogrammer.
Introduction
Adenosin (ADO) er en purinnukleosidanalog med en adenin molekyl festet til et ribose sukkermolekyl gruppen via en glykosidbinding. Når den er tilstede i det ekstracellulære miljøet, beskytter cellene mot overdreven skade ved virkningen av immunsystemet. Denne rollen har blitt fremhevet ved hjelp av ulike sykdomsmodeller, for eksempel kolitt 1, diabetes 2, astma 3, sepsis 4, og iskemisk skade fem. En av hovedfunksjonene ADO er inhibering av immunresponsen hos svulsten mikromiljøet, noe som bidrar til reduksjon av tumorImmunflukt 6. Av denne grunn er de mekanismene som er involvert i dannelse og ADO signalering er av betydelig terapeutisk interesse 7.
ADO nivåer i vev mikro er forholdsvis lav under normale fysiologiske betingelser og i hvert fall under sensitivitetsgrensen på immunceller. Men under hypoksi, ischemi, inflammasjon, infeksjon, metabolskstress og svulst forvandling de raskt øke åtte. De forhøyede ekstracellulære ADO nivåer i respons til vev-perturbing signaler har en dobbel funksjon: å rapportere vev skade i en autokrint og parakrint måte og å generere vev responser som kan generelt sett på som cytoprotective.
Ekstracellulær ADO kan dannes gjennom en rekke mekanismer, som inkluderer frigivelse av intracellulære kamre mediert av nukleosid-transportører 9 eller akkumulering på grunn av nedsatt nedbrytning drives av adenosindeaminase. Den viktigste vei som fører til økte ekstracellulære nivåer ADO omfatter virkningen av en kaskade av ectonucleotidases, som er membran-assosiert ectoenzymes genererer ADO ved phosphohydrolysis av nukleotider som frigjøres fra døde eller døende celler. Denne veien går gjennom den sekvensielle handling av CD39 (ectonucleoside trifosfat diphosphohydrolase-1) som konverterer ekstracellulære adenosin 5'-trifosfat (ATP) eller adenosin-5'-difosfat (ADP) til adenosin-5'-monofosfat (AMP) og CD73 (5'-nukleotidase), som konverterer AMP til ADO 10.
Ekstracellulær ADO utløser sine fysiologiske responser ved å binde seg til fire transmembrane ADO-reseptorer, nemlig A1, A2A, A2B og A3. Hver reseptor har forskjellige affinitet for ADO og spesifikk fordeling vev. Alle reseptorene har syv transmembrandomener og er i G-proteinkoblet til intracellulære GTP-bindende proteiner (G-proteiner), som kan indusere (Gs-proteinet) eller inhiberer (Gi protein) adenylatsyklase-aktivitet og, senere, produksjonen av intracellulær cAMP. Derfor endringer i cytoplasma cAMP-nivåer innvirkning på intracellulært protein-kinase-aktivitet under fysiologiske responser 11. Under fysiologiske betingelser ekstracellulære ADO er under 1 pm, som kan aktivere ukritisk A1, A2A og A3-reseptorer. Imidlertid aktivering av A2B subtype krever betydelig høyerekonsentrasjoner av nukleosidet, for eksempel de som er oppnådd under patofysiologiske betingelser. Alternativt kan ekstracellulære ADO bli degradert til inosin (INO) av adenosindeaminase (ADA) og CD26, en ADA kompleksprotein lokalisere ADA på celleoverflaten. En annen mulighet er at ADO er internalisert av cellen gjennom nukleosidlikevektstransportør transportører (ØNH) og fosforylert til AMP av ADO kinase protein 12,13.
Formålet med denne protokollen er å beskrive en analytisk metode for revers fase høy-ytelse væskekromatografi (RP-HPLC) for å kvantifisere i en enkelt kjøring substratet AMP og produktene ADO og INO, som genereres av humane lymfocytter. Vår erfaring var i utgangspunktet oppnådd ved bruk av celler fra kronisk lymfatisk leukemi (KLL) pasienter, som er preget av utvidelsen av en moden befolkning på CD19 + / CD5 + B-lymfocytter konstitutivt uttrykker CD39 14,15. Vi viste ca 30%av KLL pasienter uttrykker CD73 ectoenzyme og at dette fenotype korrelerer med dårlig prognose 16. Denne undergruppe av leukemiceller co-uttrykker CD39 og CD73 kan aktivt produsere ekstracellulære ADO fra ADP og / eller AMP. Preinkubasjon av CD73 + CLL celler med α, β-metylen-ADP (APCP), en kjent inhibitor av CD73 enzymatisk aktivitet, fullstendig blokkerer ekstracellulære ADO syntese bekreftet at CD73 representerer en flaskehals og enzym fra det kaskade 16.
KLL celler også uttrykker ADA og ADA komplekse protein CD26, som er ansvarlig for konvertering av ADO i INO. Ved å bruke spesifikke ADA-inhibitorer, slik som erytro-9- (2-hydroksy-3-nonyl) I wiadenine (EHNA) -hydroklorid og deoksykoformycin (DCF), er det mulig å blokkere ekstracellulære ADO degraderingen INO. Videre forbehandling med en ADA-inhibitor i kombinasjon med dipyridamol, som blokkerer nukleosid transportører, forbedrer ADO akkumulering i cellensupernatanter.
Vi har deretter utvidet denne protokollen til celler som stammer fra andre linjer, inkludert T-lymfocytter og myeloide celler, bekrefter CD73-avhengig ADO produksjon. Disse funnene tyder på at denne HPLC-protokollen er meget allsidig, og at den kan brukes til forskjellige celle linjer og til forskjellige dyrkningsbetingelser (figur 1).
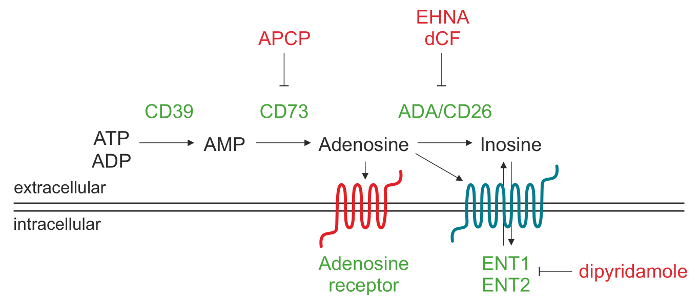
Figur 1. Skjematisk fremstilling av den enzymatiske maskineri ansvarlig for ekstracellulær ADO produksjon. Adenosin-5'-trifosfat (ATP) og / eller adenosin-5'-difosfat (ADP) kan brytes ned av CD39 til adenosin 5'-monofosfat (AMP), hvilken i sin tur omdannes av CD73 til nukleosidet adenosin (ADO). Når ADO er produsert i det ekstracellulære rom, kan det inn igjen i cellen gjennom nukleosid transportører (ENT), omdannes til inosin (INO) ellerbinde seg til forskjellige typer P1 ADO reseptorer. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Protokollen er beskrevet her gjør det mulig å evaluere aktiviteten av CD39 / CD73 adenosinergic maskineri i cellekulturmedier fra rensede humane leukemiceller. Gjennom denne HPLC metoden kan vi følge og kvantitativt måle enzymatisk generasjon av ADO (CD73-avhengig) og påfølgende degradering til INO (CD26 / ADA avhengig). Bruken av enzyminhibitorer gjør det mulig å kontrollere protokoll og for å ha intern kontroll. Fordelene og nyheter i denne protokollen er at i) den kan anvendes på celler som vokser i kultur,…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet støttes av Associazione Italiana Ricerca Cancro (IG # 12754).
Materials
| Human blood | |||
| Milli-Q water | Millipore | double deionised water | |
| Ficoll-Paque Plus | GE-Healthcare | 17-1440-03 | |
| purified anti-CD3, -CD14, -CD16 | made in-house | mouse monoclonal | |
| PE-labeled anti-CD19 | Miltenyi Biotec | 120-014-229 | |
| FITC-labeled anti-CD5 | Miltenyi Biotec | 130-096-574 | |
| Dynabeads sheep anti-mouse IgG | Invitrogen | 11031 | |
| Phosphate-buffered saline (PBS) | Amresco | E404-200TABS | tablets |
| bovine serum albumin (BSA) | ID bio | 1000-70 | standard grade |
| isolation buffer | PBS 0.1 % BSA 2 mM EDTA, pH 7.4 | ||
| AIM V serum free medium | GIBCO | 12055-091 | liquid (research grade) |
| adenosine 5’-diphosphate (ADP) | Sigma-Aldrich | A2754 | |
| adenosine 5’-monosphate (AMP) | Sigma-Aldrich | A1752 | |
| adenosine (ADO) | Sigma-Aldrich | A9251 | |
| inosine (INO) | Sigma-Aldrich | I4125 | |
| α,β-methylene-ADP (APCP) | Sigma-Aldrich | M8386 | CD73 inhibitor |
| EHNA hydrochloride | Sigma-Aldrich | E114 | adenosine deaminase inhibitor |
| Deoxycoformycin (dCF) | Tocris | 2033 | adenosine deaminase inhibitor |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dipyridamole | Sigma-Aldrich | D9766 | nucleoside transporter inhibitor |
| acetonitrile (CHROMASOLV Plus) | Sigma-Aldrich | 34998 | HPLC-grade |
| ammonium acetate | Sigma-Aldrich | 9688 | 7 mM, pH 3.0 |
| hydrochloric acid | Sigma-Aldrich | 30721-1L | min. 37 % |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Bürker cell counter | VWR | 631-0920 | hemocytometer |
| DynaMag-15 Magnet | Invitrogen | 12301D | Dynal magnetic bead separator |
| microcentrifuge safe-lock tubes | Eppendorf | 030-120-0086 | 1.5 ml |
| PET centrifuge tubes | Corning | 430053/430304 | 15 – 50 ml |
| Minisart RC4 syringe filters | Sartorius Stedim Biotech | 17821 | membrane 0.2 µm |
| short thread vials | VWR | 548-0029 | 1.5 ml/glass |
| micro-inserts | VWR | 548-0006 | 0.1 ml/glass |
| screw caps | VWR | 548-0085 | 9 mm/PP blue |
| Atlantis dC18 Column | Waters | 186001344 | 5 µm, 4.6 x 150 mm |
| Atlantis dC18 Guard Column | Waters | 186001323 | 5 µm, 4.6 x 20 mm |
| Waters Alliance 2965 Separations Module | Waters | HPLC separation module | |
| Waters 2998 Photodiode Array (PDA) Detector | Waters | UV detector | |
| Waters Empower2 software | Waters |
Riferimenti
- Naganuma, M., Wiznerowicz, E. B., Lappas, C. M., Linden, J., Worthington, M. T., Ernst, P. B. Cutting edge: Critical role for A2A adenosine receptors in the T cell-mediated regulation of colitis. J Immunology. 177 (5), 2765-2769 (2006).
- Nemeth, Z. H., et al. Adenosine receptor activation ameliorates type 1 diabetes. FASEB J. 21 (10), 2379-2388 (2007).
- Fan, M., Jamal Mustafa, S. Role of adenosine in airway inflammation in an allergic mouse model of asthma. Int Immunopharmacol. 6 (1), 36-45 (2006).
- Csoka, B., et al. A2B adenosine receptors protect against sepsis-induced mortality by dampening excessive inflammation. J Immunol. 185 (1), 542-550 (2010).
- Peart, J. N., Headrick, J. P. Adenosinergic cardioprotection: multiple receptors, multiple pathways. Pharmacol Ther. 114 (2), 208-221 (2007).
- Ohta, A., et al. A2A adenosine receptor protects tumors from antitumor T cells. Proc Natl Acad Sci U S A. 103 (35), 13132-13137 (2006).
- Hasko, G., Linden, J., Cronstein, B., Pacher, P. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases. Nat Rev Drug Discov. 7 (9), 759-770 (2008).
- Cronstein, B. N. Adenosine, an endogenous anti-inflammatory agent. J Appl Physiol (1985). 76 (1), 5-13 (1994).
- Molina-Arcas, M., Casado, F. J., Pastor-Anglada, M. Nucleoside transporter proteins. Curr Vasc Pharmacol. 7 (4), 426-434 (2009).
- Deaglio, S., et al. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression. J Exp Med. 204 (6), 1257-1265 (2007).
- Linden, J. Regulation of leukocyte function by adenosine receptors. Adv Pharmacol. 61, 95-114 (2011).
- Antonioli, L., Blandizzi, C., Pacher, P., Hasko, G. Immunity, inflammation and cancer: a leading role for adenosine. Nat Rev Cancer. 13 (12), 842-857 (2013).
- Antonioli, L., Csoka, B., Fornai, M., et al. Adenosine and inflammation: what’s new on the horizon. Drug Discov Today. 19 (8), 1051-1068 (1051).
- Chiorazzi, N., Rai, K. R., Ferrarini, M. Chronic lymphocytic leukemia. N Engl J Med. 352 (8), 804-815 (2005).
- Abousamra, N. K., Salah El-Din, M., Hamza Elzahaf, E., Esmael, M. E. Ectonucleoside triphosphate diphosphohydrolase-1 (E-NTPDase1/CD39) as a new prognostic marker in chronic lymphocytic leukemia. Leuk Lymphoma. 56 (1), 113-119 (2015).
- Serra, S., et al. CD73-generated extracellular adenosine in chronic lymphocytic leukemia creates local conditions counteracting drug-induced cell death. Blood. 118 (23), 6141-6152 (2011).
- Chen, L. S., Keating, M. J., Gandhi, V. Blood collection methods affect cellular protein integrity: implications for clinical trial biomarkers and ZAP-70 inn CLL. Blood. 124 (7), 1192-1195 (2014).
- Kalina, T., et al. EuroFlow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 26 (9), 1986-2010 (2012).
- Deaglio, S., et al. CD38 and ZAP-70 are functionally linked and mark CLL cells with high migratory potential. Blood. 110 (12), 4012-4021 (2007).
- Sachsenmeier, K. F., et al. Development of a novel ectonucleotidase assay suitable for high-throughput screening. J Biomol Screen. 17 (7), 993-998 (2012).

