مقارنة التبغ طرق إزالة المضيف بروتين الخلية من قبل السلق النباتات سليمة أو عن طريق المعالجة الحرارية من مقتطفات
Summary
ثلاثة الحرارة وتعرض أساليب هطول الأمطار التي تزيل بشكل فعال أكثر من 90٪ من بروتينات الخلية المضيفة (HCPs) من التبغ المستخلصات قبل أي خطوة تنقية أخرى. محطة HCPs تتجمع بشكل لا رجعة فيه في درجات حرارة أعلى من 60 درجة مئوية.
Abstract
النباتات ليس فقط توفير الغذاء والعلف والمواد الخام للبشر، ولكن وضعت أيضا كنظام إنتاج اقتصادي للبروتينات الصيدلانية البيولوجية، مثل الأجسام المضادة، والمرشحين لقاح والانزيمات. هذه يجب تطهيره من الكتلة الحيوية النباتية ولكن تعوقهم الخطوات اللوني من تركيزات عالية من البروتينات الخلية المضيفة (HCPs) في المستخلصات النباتية. ومع ذلك، فإن معظم HCPs تتجمع بشكل لا رجعة فيه في درجات حرارة أعلى من 60 درجة مئوية تسهيل تنقية اللاحقة للبروتين الهدف. هنا، يتم تقديم ثلاث وسائل لتحقيق هطول حرارة HCPs التبغ في أي من الأوراق سليمة أو مقتطفات. وابيضاض الأوراق سليمة يمكن بسهولة دمجها في العمليات القائمة ولكن قد يكون لها تأثير سلبي على خطوات الترشيح لاحقة. العكس هو الصحيح لهطول الأمطار الحرارة من مستخلصات أوراق في وعاء أثار، التي يمكن أن تحسن أداء عمليات المصب ولكن مع تغييرات كبيرة في تصميم المعدات التكنولوجية، مثلهندسة الخالط. وأخيرا، الإعداد مبادل حراري ويتميز بشكل جيد من حيث شروط نقل الحرارة وسهلة الحجم، ولكن التنظيف يمكن أن يكون من الصعب، وربما يكون هناك تأثير سلبي على قدرة المرشح. أسلوب التصميم من بين التجارب يمكن استخدامها لتحديد معالم عملية الأكثر أهمية التي تؤثر إزالة المندوبية والانتعاش المنتج. هذا يسهل تطبيق كل طريقة في التعبير منصات أخرى، وتحديد الأسلوب الأكثر مناسبة لوضع استراتيجية تنقية معين.
Introduction
تعتمد أنظمة الرعاية الصحية الحديثة بشكل متزايد على البروتينات الصيدلانية البيولوجية 1. إنتاج هذه البروتينات في النباتات هو مفيد نظرا لعبء الممرض منخفض وزيادة قابلية مقارنة بالأنظمة التقليدية التعبير 2-4. ومع ذلك، فإن التجهيز النهائي (DSP) من الأدوية المشتقة من النباتات يمكن أن يكون تحديا لأن إجراءات استخراج التخريبية تؤدي إلى عبء جسيم عالية، مع turbidities تتجاوز 5000 وحدة nephelometric التعكر (NTUs)، وبروتين الخلية المضيفة (المندوبية) تركيزات غالبا ما يتجاوز 95 ٪ [م / م] 5،6.
ويلزم توضيح إجراءات معقدة لإزالة جزيئات متفرقة 7-9، ولكن المعدات اللوني هو اقل كلفة للعمل في وضع مأزق، وأزل خلال الانتعاش المنتجات الأولية إذا كان هناك خطوة سابقة لإزالة فعالة من HCPs 10،11. ويمكن تحقيق ذلك إما عن طريق ترسيب البروتين الهدف باستخدام flocculالنمل 12 أو منخفضة الحموضة 13،14، وكذلك عن طريق التسبب في HCPs لتجميع. تجميع انتقائي من ريبولوز-1،5-bisphosphate كربوكسيلاز / أوكسيجيناز (RuBisCO)، والمندوبية الأكثر وفرة في النباتات الخضراء مثل التبغ (النيكوتين تبغ)، يمكن تعزيز بإضافة البولي ايثيلين جلايكول 15، ولكن هذا غير مكلفة وغير متوافقة مع كبير التصنيع -scale. وقد تبين أن المعالجة الحرارية لتفسد ويعجل أكثر من 95٪ من HCPs التبغ، في حين تبقى المرشحين لقاح الملاريا البروتين مثل Vax8 مستقر في حل 16-18.
تم استخدام ثلاثة أساليب مختلفة لتحقيق هطول الأمطار الناجمة عن الحرارة من HCPs التبغ: (ط) ابيضاض، أي غمر أوراق سليمة في السائل الساخن، (ب) درجة الحرارة التي تسيطر عليها أثار السفينة، و (iii) مبادل حراري ( الشكل 1) 16. لأوراق سليمة، وابيضاض حقق هطول السريع والفعال للHCPs وكان أيضا من السهللزيادة ومتوافقة مع عمليات التصنيع على نطاق واسع القائمة التي تتضمن الخطوة الأولى لغسل الكتلة الحيوية النباتية 19. في المقابل، سفن التحكم في درجة حرارته متاحة بالفعل في بعض العمليات، ويمكن استخدامها لعلاج الحرارية من المستخلصات النباتية 20، ولكن قابلية وسرعة نقل الطاقة محدودة لأن نسبة الدبابات السطح إلى الحجم تخفض تدريجيا و يصبح غير مناسب في نطاق العملية. مبادل حراري هو بديل من الناحية الفنية واضحة المعالم لتسخين الأوعية أثار ولكن يتطلب وفرة من التدفئة ووسائل الإعلام التبريد، على سبيل المثال، البخار والماء البارد، وكذلك معدل التدفق الحجمي لرقابة مشددة أن يتكيف مع هندسة مبادل حراري و خصائص وسائل الإعلام، على سبيل المثال، القدرة حرارة معينة. يوضح هذا المقال كيف أن كل الطرق الثلاث يمكن استخدامها لهطول الأمطار الناجمة عن الحرارة من HCPs التبغ، وHCPs النبات بشكل عام. إنشاء وتشغيل مجموعة شرق افريقياطريقة ساعة في إعداد مختبر يمكن استخدامها لتقييم مدى ملاءمتها لعمليات واسعة النطاق. التحدي الرئيسي هو تحديد نماذج مصغرة لأسفل الكافية والظروف الترشح لكل عملية تشبه الأجهزة والظروف التي استخدمت خلال عملية التصنيع على نطاق و. البيانات المقدمة هنا تشير إلى التجارب التي أجريت مع نباتات التبغ المعدلة وراثيا معربا عن مرشح لقاح الملاريا Vax8 والبروتين الفلوري عن dsRed 16، ولكن تم أيضا طبقت طريقة بنجاح إلى N. النباتات benthamiana يعبرون عن عابر البروتينات الصيدلانية البيولوجية الأخرى 21.
والتجارب التصميم من (وزارة الطاقة) نهج 22 يمكن أن تسهل عملية التنمية، والمرسب 23 ويمكن أيضا أن تكون مفيدة في هذا السياق كما هو موضح سابقا 8. والفرق الرئيسي بين ابيضاض والأوعية الساخنة والمبادلات الحرارية هو أن يتم تطبيق ابيضاض لأوراق سليمة في وقت مبكر من عملية في حين أن التمديديتم تطبيق لها على المستخلصات النباتية (الشكل 1).
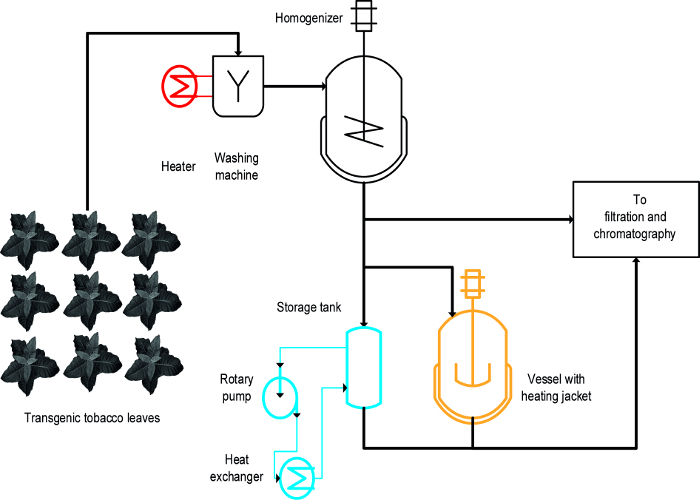
الشكل 1: مخطط تدفق عملية يوضح تنفيذ ثلاثة طرق مختلفة للتبغ المندوبية الحرارة الهطول يغسل المواد النباتية والمتجانس قبل توضيح وتنقية. يمكن بسهولة أن تضاف المعدات اللازمة لخطوة ابيضاض (أحمر) إلى الآلية القائمة. في المقابل، وذلك باستخدام سفينة أثار (برتقالي) وخصوصا مبادل حراري (الأزرق) يتطلب واحد أو عدة أجهزة إضافية والأنابيب. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
الطرق الثلاثة لهطول الأمطار الحرارة المذكورة أعلاه يمكن أن تزيل بفعالية HCPs التبغ قبل أي تنقية خطوة الكروماتوغرافي 16،17. وهي تكمل غيرها من الاستراتيجيات التي تهدف إلى زيادة نقاء الأولي المنتج، على سبيل المثال، تعرق النبات 29، rhizosecretion 30 أو الطرد ?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
Riferimenti
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

