Sammenligning af Tobak Host Cell Protein Removal Metoder ved Blanchering Intakte Planter eller ved varmebehandling af ekstrakter
Summary
Tre varme fældningsmetoder præsenteres som effektivt fjerner mere end 90% af værtscelleproteiner (HCPS) fra tobaksekstrakter forud for enhver anden oprensningstrin. Anlægget HCPS irreversibelt aggregerer ved temperaturer over 60 ° C.
Abstract
Planter ikke kun give fødevarer, foder og råvarer til mennesker, men er også blevet udviklet som et økonomisk system til biofarmaceutiske proteiner, såsom antistoffer, vaccinekandidater og enzymer produktion. Disse skal oprenses fra plantebiomassen men kromatografitrin hindres af de høje koncentrationer af værtscelleproteiner (HCPS) i planteekstrakter. Men de fleste HCPS irreversibelt aggregerer ved temperaturer over 60 ° C letter efterfølgende oprensning af målproteinet. Her er tre metoder præsenteres for at opnå den varme udfældning af tobak HCPS i enten intakte blade eller ekstrakter. Den blegning af intakte blade kan nemt indarbejdes i eksisterende processer, men kan have en negativ indvirkning på de efterfølgende filtrering trin. Det modsatte er tilfældet for varme udfældning af blade ekstrakter i en omrørt beholder, der kan forbedre ydeevnen af nedstrøms operationer omend med større ændringer i procesudstyr design, såsomhomogenisator geometri. Endelig er en varmeveksler setup godt karakteriseret i form af varmeoverførsel betingelser og let at skala, men rengøring kan være svært, og der kan være en negativ indvirkning på filter kapacitet. Udformningen-of-eksperimenter tilgang kan bruges til at identificere de mest relevante procesparametre påvirker HCP fjernelse og produkt opsving. Dette letter anvendelsen af hver metode i andre ekspressionssystemer platforme og identifikation af den mest egnede metode til en given oprensning strategi.
Introduction
Moderne sundhedssystemer i stigende afhængige af biofarmaceutiske proteiner 1. Producerer disse proteiner i planter er fordelagtig på grund af den lave patogen byrde og større skalerbarhed i forhold til konventionelle ekspressionssystemer 2-4. downstream (DSP) af planteafledte lægemidler kan imidlertid være udfordrende, fordi de forstyrrende ekstraktionsmetoder resulterer i en høj partikel byrde, med turbiditeter overstiger 5.000 nefelometrisk turbiditetsenheder (NTU'er), og værtscelleprotein (HCP) koncentrationer ofte overstiger 95 % [m / m] 5,6.
Udarbejde procedurer for præcisering er forpligtet til at fjerne spredte partikler 7-9, men kromatografi udstyr er billigere at operere i binde-og-elueringsmetode under indledende opsving produkt, hvis der er en tidligere trin til effektiv fjernelse af HCPS 10,11. Dette kan opnås enten ved udfældning målproteinet under anvendelse flocculmyrer 12 eller lav pH 13,14, samt ved at hjælpe HCPS at aggregere. Den selektive aggregering af ribulose-1,5-bisphosphat-carboxylase / oxygenase (RuBisCO), den mest udbredte HCP i grønne planter såsom tobak (Nicotiana tabacum), kan fremmes ved tilsætning af polyethylenglycol 15, men dette er dyrt og uforenelig med stor -skala produktion. Varmebehandling har vist sig at denaturere og bundfald mere end 95% af tobaksvarer HCPS, mens protein malaria vaccinekandidater såsom Vax8 forblive stabil i opløsning 16-18.
Tre forskellige fremgangsmåder blev anvendt til at opnå den varme-igangsat bundfældning af tobaksvarer HCPS: (i) blanchering, dvs. nedsænkning af intakte blade i varm væske, (ii) en temperaturreguleret omrørt beholder, og (iii) en varmeveksler ( Figur 1) 16. For intakte blade, blanchering opnås en hurtig og effektiv udfældning af HCPS og var også letat skalere op og forenelige med eksisterende store fremstillingsprocesser, der omfatter et første skridt til at vaske plantebiomassen 19. I modsætning hertil temperaturstyrede skibe er allerede tilgængelige i nogle processer, og kan bruges til termisk behandling af planteekstrakter 20, men deres skalerbarhed og energi overførselshastighed er begrænset, fordi overfladen-til-volumen-forhold af tankene nedsættes gradvis og bliver uegnet til proces skala. En varmeveksler er en teknisk veldefineret alternativ til opvarmet omrørte fartøjer, men kræver en rigelig forsyning af opvarmning og afkøling medier, fx damp og koldt vand, samt et tæt kontrolleret volumetriske strømningshastighed, der er indrettet til varmeveksleren geometri og medier egenskaber, f.eks., den specifikke varmekapacitet. Denne artikel viser, hvordan alle tre metoder kan anvendes til varmeinduceret udfældning af tobak HCPS og planteprodukter HCPS generelt. Etablering og drift af EACh metode i et laboratorium indstilling kan anvendes til at vurdere deres egnethed til større målestok processer. Den største udfordring er at identificere passende skala-down modeller og driftsforhold for hver operation, der ligner enheder og betingelser, der anvendes under processen skala produktion. De data, der præsenteres her refererer til eksperimenter udført med transgene tobaksplanter, der udtrykker malariavaccine kandidat Vax8 og fluorescerende protein DsRed 16, men metoden har også været anvendt med succes til N. benthamiana planter transient udtrykker andre biofarmaceutiske proteiner 21.
Et design-for-eksperimenter (DOE) nærmer 22 kan lette procesudvikling, og flokkuleringsmidler 23 kan også være en fordel i denne sammenhæng som tidligere beskrevet 8. Den væsentligste forskel mellem blanchering, opvarmede beholdere og varmevekslere er, at blanchering anvendes til intakte blade tidligt i processen hvorimod othendes anvendes på planteekstrakter (figur 1).
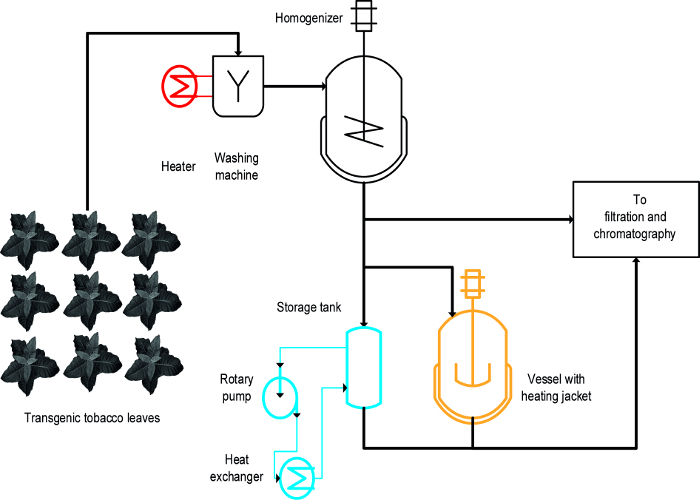
Figur 1:. Process Flow skema, der illustrerer gennemførelse af tre forskellige metoder til Tobacco HCP Heat Nedbør Plantematerialet vaskes og homogeniseres før afklaring og rensning. Udstyret til blancheringstrinnet (rød) kan let tilføjes til eksisterende maskineri. I modsætning hertil bruger en omrørt beholder (orange) og især en varmeveksler (blå) kræver en eller flere andre enheder og slanger. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
De tre metoder til varme nedbør beskrevet ovenfor effektivt kan fjerne tobak HCPS før enhver kromatografisk oprensning trin 16,17. De supplerer andre strategier, der tager sigte på at øge oprindelige produkt renhed, f.eks guttation 29, rhizosecretion 30 eller centrifugal udvinding 31,32, som alle er begrænset til udskilte proteiner. Imidlertid kan varme-baserede metoder kun anvendes på en meningsfuld måde, hvis målproteinet der skal oprenses kan modstå den mi…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
Riferimenti
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

