Vergleich von Tabakwirtszellprotein Abbaumethoden von Intact Pflanzen oder Blanchieren durch Wärmebehandlung von Extrakten
Summary
Drei Wärmefällungsverfahren vorgestellt werden, die effektiv mehr als 90% der Wirtszellproteine (HCP) von Tabak entfernen Extrakte vor jeder anderen Reinigungsschritt. Die Anlage HCPs aggregieren irreversibel bei Temperaturen über 60 ° C.
Abstract
Pflanzen bieten nicht nur Nahrung, Futter und Rohstoffen für Menschen, sondern auch als wirtschaftliche Produktionssystem für biopharmazeutischer Proteine, wie Antikörper, Impfstoffe und Enzymen entwickelt. Diese müssen von der pflanzlichen Biomasse gereinigt werden, sondern Chromatographieschritte werden durch die hohen Konzentrationen von Wirtszellproteinen (HCPs) in Pflanzenextrakten behindert. Jedoch aggregieren meisten HCPs irreversibel bei Temperaturen über 60 ° C erleichtert die anschließende Reinigung des Zielproteins. Hier werden drei Methoden vorgestellt, die Wärme Ausfällung von Tabak HCP entweder in intakten Blättern oder Extrakte zu erzielen. Das Blanchieren von intakten Blättern kann leicht in bestehende Prozesse integriert werden, aber negative Auswirkungen auf die nachfolgende Filtrationsschritte haben können. Das Gegenteil ist für die Wärme Ausfällung von Blattextrakten in einem Rührkessel wahr, der die Performance des Downstream-Aktivitäten, wenn auch mit großen Veränderungen in Prozessanlagen Design verbessern können, wie zum BeispielHomogenisator Geometrie. Schließlich wird ein Wärmetauscher-Setup auch im Hinblick auf die Wärmeübergangsbedingungen und leicht zu Skala gekennzeichnet, aber die Reinigung kann schwierig sein, und es kann einen negativen Einfluss auf die Filterkapazität sein. Das Design-of-Experimente Ansatz können die meisten relevanten Prozessparameter beeinflussen HCP Entfernung und Produktgewinnung zu identifizieren. Dies erleichtert die Anwendung der einzelnen Methoden in andere Expressionsplattformen und die Identifizierung der am besten geeignete Methode für eine gegebene Reinigungsstrategie.
Introduction
Moderne Gesundheitssysteme zunehmend von biopharmazeutischen Proteinen 1. Herstellung dieser Proteine in Pflanzen ist vorteilhaft , aufgrund der geringen pathogen Belastung und höhere Skalierbarkeit im Vergleich zu herkömmlichen Expressionssysteme 2-4. Allerdings ist die Downstream-Processing (DSP) von pflanzlichen Arzneimitteln kann eine Herausforderung sein, weil die störenden Extraktionsverfahren in einer hohen Partikelbelastung zur Folge haben, mit Trübungen von mehr als 5.000 nephelometrischen Trübungseinheiten (NTU) und Wirtszellprotein (HCP) Konzentrationen oft 95 überschreitet % [m / m] 5,6.
Aufwendige Klärungsverfahren sind erforderlich , um dispergierte Teilchen zu entfernen 7-9, aber Chromatographie Ausrüstung ist weniger teuer in bind-and-eluieren Modus während der anfänglichen Produktgewinnung zu betreiben , wenn ein früherer Schritt für die effiziente Entfernung von HCPs 10,11 ist. Dies kann entweder erreicht werden, indem das Zielproteinfällungs floccul VerwendungAmeisen 12 oder niedrigen pH 13,14 sowie durch die HCPs zu aggregieren verursacht. Die selektive Aggregation von Ribulose-1,5-bisphosphat – Carboxylase / Oxygenase (RuBisCO), das am reichlichsten vorhandene HCP in grünen Pflanzen wie Tabak (Nicotiana tabacum), kann durch Zugabe von Polyethylenglykol 15 gefördert werden, dies ist jedoch teuer und nicht mit großer -Skala Fertigung. Wärmebehandlung wurde mehr als 95% des Tabaks HCPs gezeigt zu denaturieren und auszufällen, während Protein Malaria – Impfstoffkandidaten wie Vax8 stabil bleiben in Lösung 16-18.
Drei verschiedene Ansätze wurden verwendet , um die wärmeinduzierte Ausfällung von Tabak HCPs zu erreichen: (i) blanchiert, das heißt das Eintauchen von intakten Blättern in heiße Flüssigkeit, (ii) ein temperaturgesteuertes Gefäß gerührt, und (iii) einen Wärmetauscher ( Abbildung 1) 16. Für intakte Blätter, Blanchieren der eine schnelle und effiziente Fällung von HCP erreicht und war auch leichtFertigungsprozesse zu skalieren und kompatibel mit bestehenden großen , die einen ersten Schritt umfassen 19 die pflanzliche Biomasse zu waschen. Im Gegensatz dazu, temperaturgeregelten Behälter sind bereits in einigen Prozessen zur Verfügung und kann für die thermische Behandlung von Pflanzen 20 extrahiert verwendet werden, aber ihre Skalierbarkeit und Energieübertragungsrate begrenzt , weil die Oberfläche-zu-Volumen – Verhältnis der Tanks schrittweise verringert wird und wird im Prozessmaßstab ungeeignet. Ein Wärmetauscher ist ein technisch gut definierte alternative Rührkessel zu erwärmenden erfordert aber eine reichliche Zufuhr von Heiz- und Kühlmedien, beispielsweise Dampf und kaltem Wasser sowie eine streng kontrollierten Volumenstrom, der zu dem Wärmetauscher Geometrie angepasst ist , und Medieneigenschaften, z. B. die spezifische Wärmekapazität. Dieser Artikel zeigt, wie alle drei Methoden können für die wärmeinduzierte Ausfällung von Tabak Vertreter des Gesundheitswesens und Pflanzen Vertreter des Gesundheitswesens im Allgemeinen verwendet werden. Die Errichtung und der Betrieb von each Methode in einer Laborumgebung kann verwendet werden, um ihre Eignung Prozesse für größere zu bewerten. Die große Herausforderung ist für jede Operation, die die Geräte und Bedingungen in angemessenem Umfang verkleinerten Modellen und Betriebsbedingungen zu identifizieren, während im Prozessmaßstab Herstellung verwendeten ähneln. Die hier präsentierten Daten beziehen sich auf Versuche mit transgenen Tabakpflanzen durchgeführt DsRed die Malaria – Impfstoffkandidaten Vax8 und fluoreszierende Protein exprimieren , 16, aber das Verfahren auch auf N. erfolgreich angewandt wurde benthamiana Pflanzen transient exprimieren andere biopharmazeutische Proteine 21.
Ein Design-of-Experiments (DoE) Ansatz 22 kann die Prozessentwicklung zu erleichtern, und Flockungsmittel 23 in diesem Zusammenhang auch von Vorteil sein kann , wie zuvor 8 beschrieben. Der wesentliche Unterschied zwischen dem Bleichen, dem beheizten Behältern und Wärmetauscher ist, dass Abblassen auf intakte Blätter früh in den Prozess während der ot angewendet wirdihr sind Pflanzenextrakte (Abbildung 1) aufgebracht.
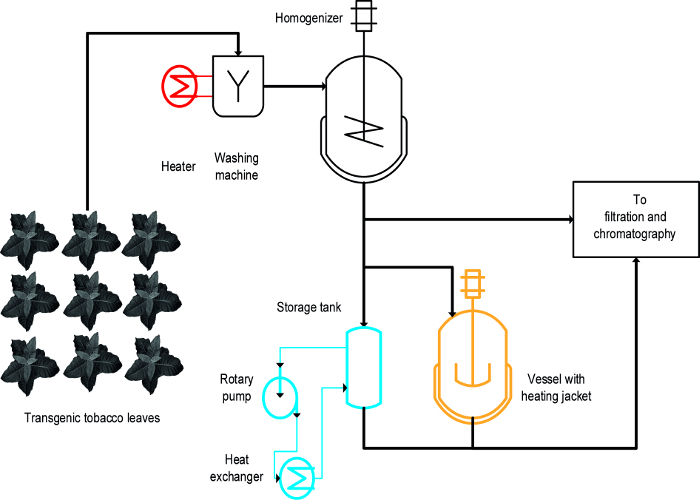
Abb . 1: Fließschema Prozess zeigt die Umsetzung der drei verschiedene Methoden zur Tabak HCP Wärme Precipitation Das Pflanzenmaterial wird gewaschen und homogenisiert vor Klärung und Reinigung. Die Ausrüstung für die Blanchierschritt (rot) leicht an die vorhandenen Maschinen hinzugefügt werden. Im Gegensatz dazu ist ein Rührkessel (orange) mit und insbesondere einen Wärmetauscher (blau) erfordert eine oder mehrere zusätzliche Geräte und Schläuche. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
Die drei Verfahren zur Hitzefällung oben beschrieben , kann effektiv Tabak HCP vor jeder chromatographischen Reinigungsschritt 16,17 entfernen. Sie ergänzen andere Strategien , die anfängliche Produktreinheit zu erhöhen zielen darauf ab , zum Beispiel Guttation 29, rhizosecretion 30 oder Zentrifugalextraktion 31,32, die alle auf sekretierte Proteine beschränkt sind. Jedoch können die Wärmebasierte Verfahren nur dann sinnvoll genutzt werden, wenn das Zielp…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
Riferimenti
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

