बरकरार पौधों blanching द्वारा या अर्क की गर्मी उपचार द्वारा तंबाकू मेजबान कोशिका प्रोटीन को हटाने के तरीकों की तुलना
Summary
तीन गर्मी वर्षा के तरीकों को प्रभावी ढंग से प्रस्तुत कर रहे हैं कि तंबाकू से मेजबान कोशिका प्रोटीन (HCPs) की 90% से अधिक दूर करने के लिए किसी भी अन्य शुद्धि कदम से पहले निकालता है। संयंत्र HCPs अचल 60 डिग्री सेल्सियस से ऊपर तापमान पर कुल।
Abstract
पौधे न केवल मनुष्य के लिए भोजन, दूध और कच्चे माल उपलब्ध कराने, लेकिन यह भी इस तरह के एंटीबॉडी, टीका उम्मीदवारों और एंजाइमों के रूप में बायोफर्मासिटिकल प्रोटीन, के लिए एक किफायती उत्पादन प्रणाली के रूप में विकसित किया गया है। ये संयंत्र बायोमास से शुद्ध होना चाहिए लेकिन क्रोमैटोग्राफी कदम पौधों के अर्क में मेजबान कोशिका प्रोटीन (HCPs) की उच्च सांद्रता द्वारा बाधा कर रहे हैं। हालांकि, ज्यादातर HCPs अचल 60 डिग्री सेल्सियस से ऊपर तापमान लक्ष्य प्रोटीन के बाद शुद्धि की सुविधा पर कुल। इधर, तीन तरीकों या तो बरकरार पत्ते या अर्क में तंबाकू HCPs की गर्मी वर्षा प्राप्त करने के लिए प्रस्तुत कर रहे हैं। बरकरार पत्तियों का blanching आसानी से मौजूदा प्रक्रियाओं में शामिल किया जा सकता है, लेकिन बाद में निस्पंदन कदम पर एक नकारात्मक प्रभाव हो सकता है। विपरीत एक उभारा पोत में पत्ता अर्क की गर्मी वर्षा, जो इस तरह के रूप में इस प्रक्रिया उपकरणों के डिजाइन में बड़े बदलाव, यद्यपि के साथ नीचे की ओर संचालन के प्रदर्शन में सुधार कर सकते हैं के लिए सच हैhomogenizer ज्यामिति। अंत में, एक हीट एक्सचेंजर सेटअप अच्छी तरह से गर्मी हस्तांतरण की स्थिति के संदर्भ में होती है और बड़े पैमाने करने के लिए आसान है, लेकिन सफाई के लिए मुश्किल हो सकता है और फिल्टर क्षमता पर नकारात्मक असर पड़ सकता है। डिजाइन के-प्रयोगों दृष्टिकोण HCP हटाने और उत्पाद वसूली प्रभावित करने वाले सबसे अधिक प्रासंगिक प्रक्रिया पैरामीटर की पहचान करने के लिए इस्तेमाल किया जा सकता है। यह अन्य अभिव्यक्ति प्लेटफार्मों में प्रत्येक विधि और एक दिया शुद्धि रणनीति के लिए सबसे उपयुक्त विधि की पहचान के आवेदन की सुविधा।
Introduction
आधुनिक स्वास्थ्य सिस्टम तेजी से बायोफर्मासिटिकल प्रोटीन 1 पर निर्भर करते हैं। पौधों में ये प्रोटीन के उत्पादन के पारंपरिक अभिव्यक्ति सिस्टम 2-4 की तुलना में कम रोगज़नक़ बोझ और अधिक से अधिक scalability के कारण फायदेमंद है। हालांकि, संयंत्र व्युत्पन्न दवाइयों के बहाव प्रोसेसिंग (डीएसपी) चुनौतीपूर्ण हो सकता है क्योंकि विघटनकारी निष्कर्षण प्रक्रियाओं turbidities 5000 Nephelometric मैलापन इकाइयों (NTUs) से अधिक है, और मेजबान कोशिका प्रोटीन (HCP) सांद्रता अक्सर 95 से अधिक के साथ एक उच्च कण बोझ में परिणाम, % [एम / एम] 5,6।
विस्तृत स्पष्टीकरण प्रक्रियाओं बिखरे कणों 7-9 दूर करने के लिए आवश्यक हैं, लेकिन क्रोमैटोग्राफी उपकरण कम प्रारंभिक उत्पाद वसूली के दौरान बाँध और Elute मोड में संचालित करने के लिए HCPs 10,11 के कुशल हटाने के लिए पहले के एक कदम है, तो महंगा है। इस लक्ष्य प्रोटीन floccul का उपयोग कर सकते हैं या तो precipitating द्वारा प्राप्त किया जा सकताचींटियों 12 या कम पीएच 13,14, साथ ही HCPs कुल करने के लिए पैदा कर रहा है। Ribulose-1,5-बाइफोस्फेट carboxylase / oxygenase (RuBisCO), इस तरह के तंबाकू (निकोटियाना Tabacum) के रूप में हरे पौधों में सबसे प्रचुर मात्रा में HCP, के चुनिंदा एकत्रीकरण पॉलीथीन ग्लाइकोल 15 जोड़कर पदोन्नत किया जा सकता है, लेकिन यह महंगा है और बड़े के साथ असंगत है -scale विनिर्माण। गर्मी उपचार denature और तंबाकू HCPs के 95% से अधिक वेग, जबकि इस तरह के Vax8 के रूप में प्रोटीन मलेरिया वैक्सीन उम्मीदवारों समाधान 16-18 में स्थिर रहने के लिए दिखाया गया है।
(I) blanching, यानी, गर्म तरल में बरकरार पत्तियों का विसर्जन, (ii) एक तापमान नियंत्रित हड़कंप मच गया पोत, और (iii) एक हीट एक्सचेंजर (: तीन अलग अलग दृष्टिकोण तंबाकू HCPs की गर्मी प्रेरित वर्षा प्राप्त करने के लिए इस्तेमाल किया गया चित्रा 1) 16। बरकरार पत्तियों के लिए, HCPs के तेजी से और कुशल वर्षा हासिल की और भी आसान था blanchingपैमाने पर और मौजूदा बड़े पैमाने पर विनिर्माण प्रक्रियाओं है कि संयंत्र बायोमास 19 धोने के लिए एक प्रारंभिक कदम शामिल हैं के साथ संगत करने के लिए। इसके विपरीत, तापमान नियंत्रित जहाजों पहले से ही कुछ प्रक्रियाओं में उपलब्ध हैं और के लिए संयंत्र के थर्मल उपचार के अर्क 20 है, लेकिन उनके scalability और ऊर्जा हस्तांतरण दर सीमित कर रहे हैं इस्तेमाल किया जा सकता है, क्योंकि टैंकों की सतह से मात्रा के अनुपात उत्तरोत्तर कम हो जाता है और प्रक्रिया पैमाने पर अनुपयुक्त हो जाता है। एक हीट एक्सचेंजर एक तकनीकी रूप से अच्छी तरह से परिभाषित विकल्प हड़कंप मच गया वाहिकाओं गरम किया जाता है, लेकिन हीटिंग और ठंडा मीडिया, जैसे, भाप और ठंडे पानी की आपूर्ति की भरमार है, साथ ही एक कसकर नियंत्रित बड़ा प्रवाह दर है कि हीट एक्सचेंजर ज्यामिति के लिए अनुकूल है की आवश्यकता है और मीडिया गुण, उदा।, विशिष्ट उष्मा। इस लेख से पता चलता है कि कैसे सभी तीन तरीकों को सामान्य रूप में तंबाकू HCPs, और संयंत्र HCPs की गर्मी प्रेरित वर्षा के लिए इस्तेमाल किया जा सकता है। स्थापना और पूर्वी वायु कमान के ऑपरेशनएक प्रयोगशाला स्थापित करने में ज विधि बड़े पैमाने पर प्रक्रियाओं के लिए उनकी उपयुक्तता का मूल्यांकन करने के लिए इस्तेमाल किया जा सकता है। बड़ी चुनौती प्रत्येक ऑपरेशन है कि उपकरणों और शर्तों प्रक्रिया पैमाने पर निर्माण के दौरान इस्तेमाल के समान के लिए पर्याप्त पैमाने नीचे मॉडल बनाने और चलाने की स्थिति की पहचान है। यहाँ प्रस्तुत डेटा ट्रांसजेनिक पौधों तंबाकू मलेरिया वैक्सीन उम्मीदवार Vax8 और फ्लोरोसेंट प्रोटीन व्यक्त DsRed 16 के साथ किए गए प्रयोगों का उल्लेख है, लेकिन विधि भी सफलतापूर्वक एन लिए आवेदन किया है benthamiana पौधों क्षणिक अन्य बायोफर्मासिटिकल प्रोटीन 21 व्यक्त।
एक डिजाइन के-प्रयोगों (डीओई) 22 दृष्टिकोण के विकास की प्रक्रिया को सुविधाजनक बनाने के कर सकते हैं और flocculants 23 भी रूप में पहले 8 वर्णित इस संदर्भ में फायदेमंद हो सकता है। , Blanching गर्म वाहिकाओं और हीट एक्सचेंजर्स के बीच मुख्य अंतर यह है कि blanching जबकि ओ.टी. प्रारंभिक प्रक्रिया में बरकरार पत्तियों को लागू किया जाता हैउसकी पौधों के अर्क (चित्रा 1) को लागू कर रहे हैं।
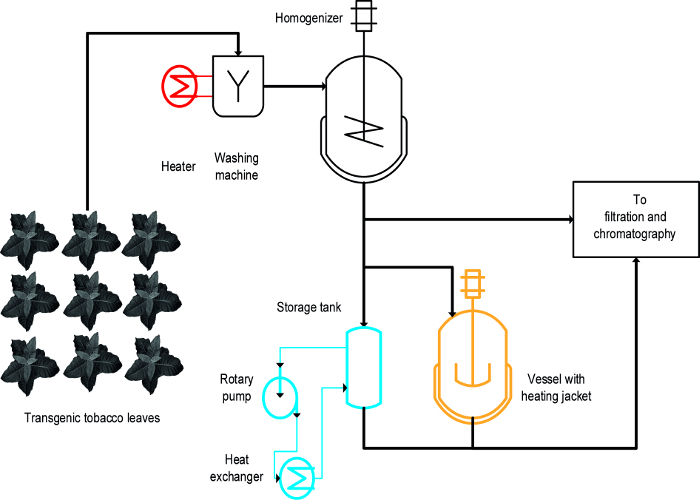
चित्रा 1:। प्रक्रिया प्रवाह योजना तंबाकू HCP हीट वर्षा के लिए तीन अलग अलग तरीकों का कार्यान्वयन दृष्टांत संयंत्र सामग्री धोया और स्पष्टीकरण और शुद्धि से पहले homogenized है। blanching कदम (लाल) के लिए उपकरण आसानी से मौजूदा मशीनरी में जोड़ा जा सकता है। इसके विपरीत, एक उभारा पोत (नारंगी) और विशेष रूप से एक हीट एक्सचेंजर (नीला) का उपयोग कर एक या कई अतिरिक्त उपकरणों और ट्यूबिंग की आवश्यकता है। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Protocol
Representative Results
Discussion
गर्मी वर्षा के लिए तीन ऊपर वर्णित विधि प्रभावी ढंग से किसी भी chromatographic शुद्धि कदम 16,17 से पहले तंबाकू HCPs निकाल सकते हैं। वे अन्य रणनीति है कि प्रारंभिक उत्पाद पवित्रता, जैसे, guttation 29, 30 या rhizosecretion के?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
Riferimenti
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

