無傷の植物をブランチングすることによって、または抽出物の熱処理によりタバコ宿主細胞タンパク質の除去方法の比較
Summary
三熱沈殿法は、効果的に前に他の精製工程にタバコ抽出物から、宿主細胞タンパク質(のHCP)の90%以上を除去することが示されています。植物のHCPは、不可逆的に60℃以上の温度で凝集します。
Abstract
植物は人間のための食品、飼料、原材料を提供するだけでなく、このような抗体、ワクチン候補と酵素などのバイオ医薬品タンパク質、のための経済的な生産システムとして開発されているだけではなく。これらは、植物バイオマスから精製されなければならないが、クロマトグラフィー工程は、植物抽出物中の宿主細胞タンパク質(のHCP)の高濃度によって妨げられます。しかし、ほとんどののHCPは、不可逆的に、標的タンパク質のその後の精製を容易にする60℃以上の温度で凝集します。ここでは、3つの方法は、無傷の葉または抽出物のいずれかでタバコのHCPの熱沈殿を達成するために提示されます。無傷の葉のブランチングを容易に既存のプロセスに組み込むことができるが、その後の濾過工程に悪影響を与えることができます。反対は、次のようなプロセス装置の設計に大きな変化、とはいえ下流操作のパフォーマンスを向上させることができ、撹拌容器、中葉抽出物の熱沈殿のために真でありますホモジナイザージオメトリ。最後に、熱交換器の設定は、熱伝達条件および拡張が容易という点で十分に特徴付けられているが、洗浄が困難であることができ、フィルタの能力に負の影響があってもよいです。デザイン・オブ・実験アプローチは、HCPの除去および生成物回収に影響を与える最も関連するプロセスパラメータを識別するために使用することができます。これは、他の発現プラットフォーム内の各メソッドと与えられた精製戦略に最も適した方法の特定のアプリケーションを容易にします。
Introduction
現代の医療システムは、ますますバイオ医薬品タンパク質1に依存しています。植物におけるこれらのタンパク質を産生することは、従来の発現系2-4と比較して、低い病原体負荷とスケーラビリティに有利で す。破壊的な抽出手順は5,000比濁分析濁度単位(NTUs)を超える濁度、及び宿主細胞タンパク質(HCP)濃度は、多くの場合、95を超えると、高い粒子負荷をもたらすしかし、植物由来の医薬品の下流の処理(DSP)は、挑戦することができ%[メートル/メートル] 5,6。
精巧な浄化手順は、分散粒子7-9を削除する必要があります。ただし、クロマトグラフィー装置はのHCP 10,11を効率的に除去するための以前のステップがある場合、最初の製品の回収時にバインドおよび溶出モードで動作するように安価であるされています。これはflocculを使用して標的タンパク質を沈殿させることによってのいずれかで達成することができますアリ12または低pH 13,14、ならびにのHCPが凝集させることもできます。リブロース-1,5-二リン酸カルボキシラーゼ/オキシゲナーゼ(のRuBisCO)の選択的な凝集は、例えば、タバコ( タバコ )などの緑色植物の中で最も豊富なHCPは、ポリエチレングリコール15を追加することによって促進することができるが、これは高価であり、大規模なと互換性がありません-scale製造。例えばVax8などのタンパク質のマラリアワクチン候補は、溶液中で安定16-18まま熱処理は、タバコのHCPの95%以上を変性し、沈殿させることが示されています。
(I)ブランチング、 すなわち、高温の液体中の無傷の葉の浸漬、(ii)の温度制御撹拌容器、および(iii)熱交換器(:三つの異なるアプローチがタバコのHCPの熱誘導沈殿を達成するために使用しました。 図1)16。無傷の葉のために、ブランチングは、のHCPの迅速かつ効率的な降水量を達成し、また簡単でしたスケールアップと植物バイオマス19を洗浄するための最初のステップを含む、既存の大規模製造プロセスに適合します。対照的に、温度制御された血管は、既にいくつかのプロセスで利用可能であり、タンクの表面対体積比が徐々に低下するため、プラントの熱処理20を抽出し 、それらのスケーラビリティとエネルギー移動速度が制限されるために使用することができるとプロセスのスケールで適さなくなります。熱交換器は、撹拌容器を加熱するために技術的に明確に定義された代替手段であるが豊富な加熱の供給およびメディア、 例えば、蒸気、冷水、冷却、ならびに熱交換器の形状に適合されている厳密に制御体積流量を必要としメディアの特性、 例えば 、特定の熱容量。この記事では、すべての3つの方法が一般的にタバコのHCP、および植物のHCPの熱による沈殿のために使用することができる方法を示しています。 EACの設立と運営実験室の設定における時間法は、大規模なプロセスのためのそれらの適合性を評価するために使用することができます。主要な課題は、プロセス規模製造中に使用されるデバイスおよび条件に似ている各操作に対して十分な縮小モデルと運転条件を識別することです。ここに提示したデータは、マラリアワクチン候補Vax8を発現するトランスジェニックタバコ植物を用いて行った実験を参照し、蛍光タンパク質は、16のDsRedが、方法はまた、成功裏にNに適用されていますbenthamiana植物は一過他のバイオ医薬品タンパク質21を発現しています 。
デザイン・オブ・実験(DOE)アプローチ22は、プロセスの開発を容易にすることができ、以前8に記載のように凝集剤23もまた、この状況において有益であり得ます。ブランチング、加熱された容器と熱交換器との間の主な違いは、ブランチングは、初期のOT一方過程で無傷の葉に適用されることです彼女は、植物抽出物( 図1)に適用されます。
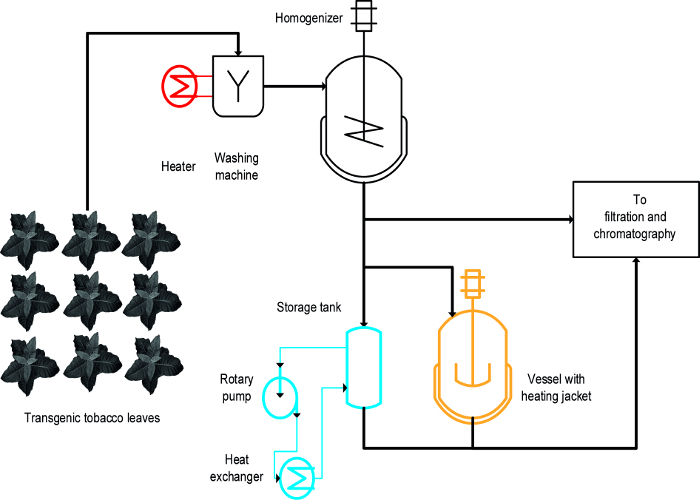
図1: タバコHCP熱降水のための3つの異なる方法の実施例を示すプロセスフロースキームは、植物材料を洗浄し、明確化し、精製前の均質化されています。ブランチング工程(赤色)のための装置は、容易に既存の機械に追加することができます。これとは対照的に、攪拌容器(橙)、特に熱交換器(青)を使用して、1つまたはいくつかの追加の機器や配管を必要とします。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Protocol
Representative Results
Discussion
上記の熱沈殿のための3つの方法が効果的に任意のクロマトグラフィー精製ステップ16,17の前にタバコのHCPを削除することができます。彼らは、分泌タンパク質に限定されているすべてのそれらの初期生成物の純度を高めることを目指して他の戦略、 例えば、排水29、rhizosecretion 30または遠心抽出31,32を 、補完します。標的タンパク質は、以上1分〜60°Cの…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
Riferimenti
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

