Сравнение методов Хост клеточных белков Удаление табака с помощью Бланшировка интактных растений или путем термической обработки экстрактов
Summary
Три тепла представлены методы осаждения, которые эффективно удалить более 90% белков клетки-хозяина (НСР) из экстракта табака до любой другой стадии очистки. Завод НСР необратимо агрегировать при температурах выше 60 ° C.
Abstract
Растения не только обеспечивают продуктов питания, кормов и сырья для человека, но также были разработаны в качестве экономичной системы производства для биофармацевтических белков, таких как антитела, вакцин-кандидатов и ферментов. Они должны быть очищены от биомассы растений, но хроматографические стадии мешают высокие концентрации белков клетки-хозяина (НСР) в растительных экстрактах. Тем не менее, большинство НСР необратимо агрегировать при температурах выше 60 ° C, облегчающих последующую очистку целевого белка. Здесь три метода представлены для достижения осаждению тепла табака ВДС в или интактными, листьев или экстрактов. Побледнение неповрежденных листьев можно легко встроить в существующие процессы, но может оказать негативное влияние на последующих стадиях фильтрации. Обратное верно для осаждения тепла листьев экстрактов в сосуде с мешалкой, которая может улучшить производительность последующих операций, хотя и с основными изменениями в конструкции технологического оборудования, таких какГомогенизатор геометрии. И, наконец, установка теплообменника хорошо характеризуется с точки зрения условий теплообмена и легко масштабировать, но очистка может быть затруднена и может быть негативное влияние на емкость фильтра. Подход дизайн-оф-экспериментов могут быть использованы для идентификации наиболее релевантных параметров процесса, влияющих на удаление HCP и восстановление продукта. Это облегчает применение каждого метода в других платформ экспрессии и определения наиболее подходящего метода для данной стратегии очистки.
Introduction
Современные системы здравоохранения все больше зависят от биофармацевтических белков 1. Производство этих белков в растениях является предпочтительным из – за низкой нагрузки патогена и большую масштабируемость по сравнению с традиционными системами экспрессии 2-4. Тем не менее, ниже по течению обработки (DSP) растительного происхождения, лекарственных средств может быть сложной задачей, поскольку подрывные процедуры извлечения приводят к высоким бременем частиц, мути превышающей 5000 нефелометрическая единиц мутности (модулей NTU), и клетка-хозяин белка (HCP) концентрации часто превышает 95 % [м / м] 5,6.
Сложные процедуры осветления необходимо удалить дисперсные частицы 7-9, но хроматографию оборудование является менее дорогостоящим для работы в режиме связывания-и-Элюции во время первоначального восстановления продукта , если есть более ранний шаг для эффективного удаления ВДС 10,11. Это может быть достигнуто либо путем осаждения белка-мишени с использованием flocculМуравьи 12 или с низким рН 13,14, а также в результате чего НСР в совокупности. Селективная агрегация рибулозо-1,5-бисфосфаткарбоксилазы / оксигеназы (RuBisCO), наиболее распространенным НСР в зеленых растениях , таких как табак (Nicotiana аЬасит), может быть ускорена добавлением полиэтиленгликоль 15, но это дорого и несовместимыми с большой -scale производства. Термообработка Было показано , что денатурации и выпадают в осадок более 95% табака ВДС, в то время как кандидаты вакцинных белок малярии , такие как Vax8 остаются стабильными в растворе 16-18.
Три различных подхода были использованы для достижения осаждения термически индуцированные табака ВДС: (I) бланширование, т.е. погружение интактных листьев в горячей жидкости, (II) с регулируемой температурой с мешалкой, и (III) , теплообменник ( Рисунок 1) 16. Для неповрежденных листьев, бланширование достигается быстрое и эффективное осаждение ВДС и также легкодля расширения и совместимо с существующими производственными процессами крупномасштабных , которые включают начальный шаг для мытья биомассы растений 19. В противоположность этому , с контролем температуры сосуды уже доступны в некоторых процессах , и может быть использован для термической обработки растительных экстрактов 20, но их масштабируемость и скорость передачи энергии ограничены , так как отношение поверхности к объему резервуаров постепенно уменьшается и становится непригодным в процессе масштабе. Теплообменник представляет собой технически четко определенной альтернативой нагревали с мешалкой , но требует обильный запас нагрева и охлаждения сред, например, пара и холодной воды, а также жестко контролируемой объемной скорости потока , который адаптирован к геометрии теплообменника и СМИ свойствами, например., удельная теплоемкость. В этой статье показано, как все три метода могут быть использованы для осаждения термически индуцированные табака ВДС и растений ВДС в целом. Создание и эксплуатация EACМетод ч в лабораторных условиях могут быть использованы для оценки их пригодности для более масштабных процессов. Основная задача состоит в том, чтобы определить адекватные модели масштаба вниз и рабочие условия для каждой операции, напоминающие устройства и условия, используемые в процессе серийного производства. Данные , представленные здесь , относятся к экспериментов , проведенных с трансгенных растений табака , экспрессирующих вакцины от малярии кандидат Vax8 и флуоресцентный белок DsRed 16, но этот метод также был успешно применен к N. benthamiana растения скоротечно экспрессирующие другие биофармацевтические белки 21.
А дизайн-оф-экспериментов (DOE) подход 22 может способствовать развитию процесса, и флокулянтов 23 также может быть полезным в этом контексте , как описано выше 8. Основное различие между бланширование, нагреваемых сосудов и теплообменников, что бланширование применяется к неповрежденным листьев на ранней стадии процесса, тогда как ВЗее наносят на растительные экстракты (рисунок 1).
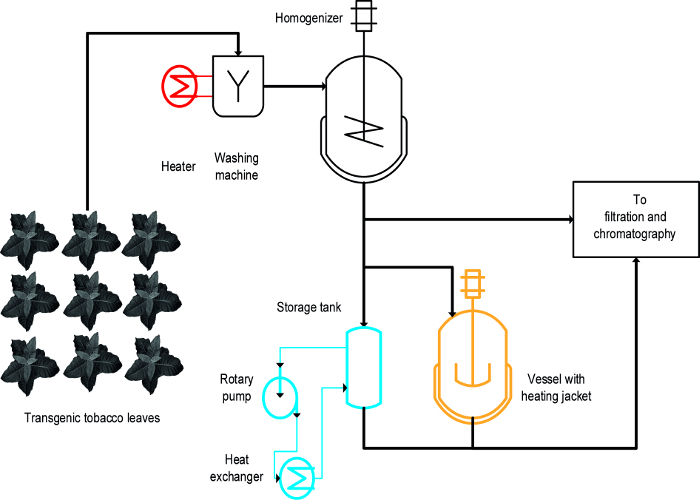
Рисунок 1:. Схема процесса Схема Иллюстрируя реализации трех различных методов Tobacco HCP тепла Осадки Растительный материал промывают и гомогенизируют перед осветлением и очистки. Оборудование для бланширования (красного цвета), могут быть легко добавлены к существующей техники. В противоположность этому , используя перемешанную сосуд (оранжевый) и особенно теплообменник (синий) требуется один или несколько дополнительных устройств и трубок. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Protocol
Representative Results
Discussion
Три метода для осаждения тепла , описанные выше , могут эффективно удалить табака HCPS до какого – либо хроматографической стадии очистки 16,17. Они дополняют другие стратегии , которые направлены на увеличение первоначальной чистоты продукта, например, гуттация 29, rhizosecretion <…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
Riferimenti
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

