Comparación de los métodos de tabaco Protein Removal célula huésped mediante escaldado plantas intactas o por tratamiento térmico de los extractos
Summary
Tres de calor se presentan métodos de precipitación que elimina de manera efectiva más de 90% de las proteínas de la célula huésped (HCP) de tabaco extrae antes de cualquier otra etapa de purificación. La planta de profesionales de la Salud irreversiblemente total a temperaturas superiores a 60 ° C.
Abstract
Las plantas no sólo proporcionan alimentos, piensos y materias primas para los seres humanos, sino que también se han desarrollado como un sistema de producción económica para las proteínas biofarmacéuticas, tales como anticuerpos, candidatas a vacunas y enzimas. Estos deben ser purificados a partir de la biomasa de la planta pero etapas de cromatografía se ven obstaculizados por las altas concentraciones de proteínas de la célula huésped (HCP) en extractos de plantas. Sin embargo, la mayoría de los profesionales de la Salud irreversiblemente agregan a temperaturas superiores a 60 ° C que facilitan la posterior purificación de la proteína diana. Aquí, tres métodos se presentan para lograr la precipitación de calor de HCP de tabaco, ya sea en hojas intactas o extractos. El blanqueo de las hojas intactas puede ser fácilmente incorporado en los procesos existentes, pero puede tener un impacto negativo en las etapas de filtración posteriores. Lo contrario es cierto para la precipitación de calor de extractos de hojas en un recipiente agitado, lo que puede mejorar el rendimiento de las operaciones aguas abajo aunque con cambios importantes en el diseño de equipos de proceso, tales comogeometría homogeneizador. Por último, una configuración de intercambiador de calor está bien caracterizado en términos de condiciones de transferencia de calor y fácil de escalar, pero la limpieza puede ser difícil y puede haber un impacto negativo en la capacidad del filtro. El enfoque de diseño de experimentos se puede utilizar para identificar los parámetros de proceso más importantes que afectan a la eliminación HCP y recuperación del producto. Esto facilita la aplicación de cada método en otras plataformas de expresión y la identificación del método más adecuado para una estrategia de purificación dado.
Introduction
Los sistemas de salud modernos dependen cada vez más de las proteínas biofarmacéuticas 1. La producción de estas proteínas en las plantas es ventajosa debido a la baja carga de patógenos y una mayor escalabilidad en comparación con los sistemas de expresión convencionales 2-4. Sin embargo, el procesamiento aguas abajo (DSP) de productos farmacéuticos derivados de plantas puede ser un reto debido a que los procedimientos de extracción de punta dan como resultado una alta carga de partículas, con turbidez inferior o igual a 5.000 unidades nefelométricas de turbidez (NTU), y la proteína de la célula huésped (HCP) las concentraciones menudo superior a 95 [m / m] 5,6%.
Se requieren procedimientos de aclaración elaborados para eliminar las partículas dispersas 7-9, pero un equipo de cromatografía es menos costoso de operar en el modo de vinculación y eluyen durante la recuperación inicial del producto si hay un paso anterior para la eliminación eficaz de los PCH 10,11. Esto se puede lograr ya sea por precipitación de la proteína diana utilizando floccul12 hormigas o de bajo pH 13,14, así como haciendo que el PCH a agregarse. La agregación selectiva de ribulosa-1,5-bisfosfato carboxilasa / oxigenasa (RuBisCO), el HCP más abundante en las plantas verdes tales como el tabaco (Nicotiana tabacum), puede promoverse mediante la adición de polietilenglicol 15, pero esto es caro e incompatible con gran -scale de fabricación. El tratamiento térmico se ha demostrado para desnaturalizar y precipitar más del 95% de los profesionales sanitarios de tabaco, mientras que los candidatos de la vacuna de la malaria proteína tales como Vax8 permanecen estables en solución 16-18.
Tres enfoques diferentes fueron usados para lograr la precipitación inducida por calor de PCH tabaco: (i) de blanqueo, es decir, la inmersión de hojas intactas en líquido caliente, (ii) una temperatura controlada recipiente de agitación, y (iii) un intercambiador de calor ( Figura 1) 16. Para hojas intactas, el blanqueado logrado la precipitación rápida y eficaz de los profesionales sanitarios y también fue fácilpara ampliar y compatible con los procesos de fabricación a gran escala existentes que incluyen un paso inicial para lavar la biomasa de la planta 19. En contraste, los vasos de temperatura controlada ya están disponibles en algunos procesos y se pueden utilizar para el tratamiento térmico de los extractos de plantas 20, pero su capacidad de ampliación y velocidad de transferencia de energía son limitados debido a que la relación de superficie a volumen de los tanques se reduce progresivamente y se convierte en no aptos a escala de proceso. Un intercambiador de calor es una alternativa técnicamente bien definido para calentar calderas de agitación, pero requiere un suministro abundante de calefacción y medios de refrigeración, por ejemplo, vapor y agua fría, así como una tasa de flujo volumétrico estrechamente controlado que se adapta a la geometría del intercambiador de calor y propiedades de medios, por ejemplo., la capacidad calorífica específica. Este artículo muestra cómo los tres métodos se pueden utilizar para la precipitación inducida por calor de HCP de tabaco, y HCP vegetales en general. El establecimiento y funcionamiento de EACmétodo h en un laboratorio puede utilizarse para evaluar su idoneidad para los procesos a mayor escala. El principal desafío es identificar modelos a escala reducida y adecuadas condiciones de funcionamiento para cada operación que se asemejan a las condiciones y dispositivos utilizados durante el proceso de fabricación a gran escala. Los datos presentados aquí se refieren a experimentos realizados con plantas de tabaco transgénicas que expresan la vacuna candidata malaria Vax8 y proteína fluorescente DsRed 16, pero el método también se ha aplicado con éxito a N. benthamiana plantas que expresaban transitoriamente otras proteínas biofarmacéuticas 21.
Un diseño-de-experimentos (DOE) se aproximan a 22 puede facilitar el desarrollo de procesos, y floculantes 23 también puede ser beneficioso en este contexto como se ha descrito previamente 8. La principal diferencia entre el escaldado, depósitos con calefacción y los intercambiadores de calor es que el escaldado se aplica a las hojas intactas al principio del proceso, mientras que el otella se aplican a extractos de plantas (Figura 1).
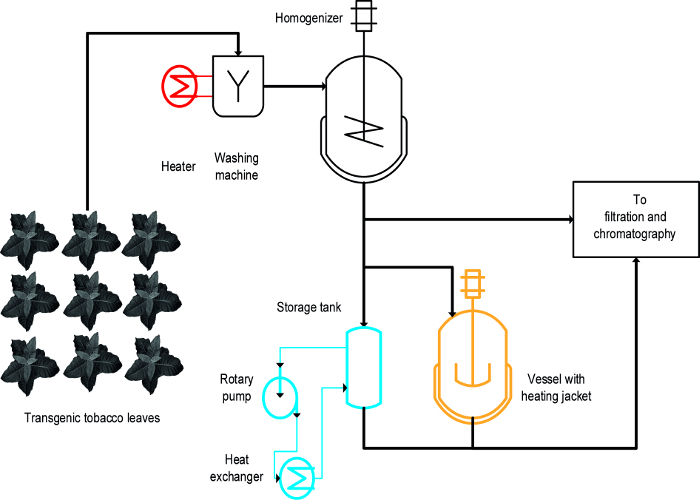
Figura 1:. Esquema del flujo de procesos que ilustra la implementación de tres diferentes métodos para Tabaco HCP precipitación térmica El material vegetal se lava y se homogeneiza antes de clarificación y purificación. El equipo para la etapa de blanqueo (rojo) se pueden añadir fácilmente a la maquinaria existente. Por el contrario, el uso de un recipiente agitado (naranja) y, especialmente, un intercambiador de calor (azul) requiere uno o varios dispositivos y tubos adicionales. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Los tres métodos de precipitación de calor descritas anteriormente pueden eliminar eficazmente los PCH de tabaco antes de cualquier etapa de purificación cromatográfica 16,17. Se complementan otras estrategias que tienen por objeto aumentar la pureza inicial del producto, por ejemplo, gutación 29, 30 o rhizosecretion centrífuga extracción de 31,32, todas las cuales se limita a las proteínas secretadas. Sin embargo, los métodos basados en el calor sólo …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge Dr. Thomas Rademacher, Alexander Boes and Veronique Beiß for providing the transgenic tobacco seeds, and Ibrahim Al Amedi for cultivating the tobacco plants. The authors wish to thank Dr. Richard M. Twyman for editorial assistance as well as Güven Edgü for providing the MSP1-19 reference. This work was funded in part by the European Research Council Advanced Grant ”Future-Pharma”, proposal number 269110, the Fraunhofer-Zukunftsstiftung (Fraunhofer Future Foundation) and Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Autoclaving basket | Nalgene | 6917-0230 | Basket for leaf blanching |
| Biacore T200 | GE Healthcare | 28-9750-01 | SPR device |
| Bio Cell Analyser BCA 003 R&D with 3D ORM | Sequip | n.a. | Particle size analyzer |
| Blender | Waring | 800EG | Blender |
| BP-410 | Furh | 2632410001 | Bag filter |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Centrifuge tube 15 mL | Labomedic | 2017106 | Reaction tube |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| CM5 chip | GE Healthcare | BR100012 | Chip for SPR measurements |
| Cuvette 10x10x45 | Sarsted | 67.754 | Cuvette for Zetasizer Nano ZS |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Twentey-loop heat exchanger (4.8 m length) | n.a. (custom design) | n.a. | Heat exchanger |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| K200P 60D | Pall | 5302303 | Depth filter layer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Water bath thermostat |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| mAb 5.2 | American Type Culture Collection | HB-9148 | Vax8 specific antibody |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Miracloth | Labomedic | 475855-1R | Filter cloth |
| MultiLine Multi 3410 IDS | WTW | WTW_2020 | pH meter / conductivity meter |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Sodium disulfit | Carl Roth GmbH | 8554.1 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Stainless-steel vessel; 0.7-kg 2.0-L; height 180 mm; diameter 120 mm | n.a. (custom design) | n.a. | Container for heat precipitation |
| Synergy HT | BioTek | SIAFRT | Fluorescence and spectrometric plate reader |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Zetasizer Nano ZS | Malvern | ZEN3600 | DLS particle size distribution measurement |
| Zetasizer Software v7.11 | Malvern | n.a. | Software to operate the Zetasizer Nano ZS device |
Riferimenti
- PhRMA. . 2013 Report: Medicines in Development – Biologics. , (2013).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Stoger, E., Fischer, R., Moloney, M., Ma, J. K. C. Plant molecular pharming for the treatment of chronic and infectious diseases. Annu. Rev. Plant Biol. 65, 743-768 (2014).
- Melnik, S., Stoger, E. Green factories for biopharmaceuticals. Curr. Med. Chem. 20, 1038-1046 (2013).
- Buyel, J. F., Twyman, R. M., Fischer, R. Extraction and downstream processing of plant-derived recombinant proteins. Biotechnol. Adv. 33, 902-913 (2015).
- Wilken, L. R., Nikolov, Z. L. Recovery and purification of plant-made recombinant proteins. Biotechnol. Adv. 30, 419-433 (2012).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnol. J. 9, 415-425 (2014).
- Buyel, J. F., Fischer, R. Flocculation increases the efficacy of depth filtration during the downstream processing of recombinant pharmaceutical proteins produced in tobacco. Plant Biotechnol. J. 12, 240-252 (2014).
- Buyel, J. F., Opdensteinen, P., Fischer, R. Cellulose-based filter aids increase the capacity of depth filters during the downstream processing of plant-derived biopharmaceutical proteins. Biotechnol. J. 10, 584-591 (2014).
- Buyel, J. F., Fischer, R. Generic chromatography-based purification strategies accelerate the development of downstream processes for biopharmaceutical proteins produced in plants. Biotechnol. J. 9, 566-577 (2014).
- Buyel, J. F., Woo, J. A., Cramer, S. M., Fischer, R. The use of quantitative structure-activity relationship models to develop optimized processes for the removal of tobacco host cell proteins during biopharmaceutical production. J. Chromatogr. A. 1322, 18-28 (2013).
- Holler, C., Vaughan, D., Zhang, C. M. Polyethyleneimine precipitation versus anion exchange chromatography in fractionating recombinant beta-glucuronidase from transgenic tobacco extract. J. Chromatogr. A. 1142, 98-105 (2007).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5, 138-142 (2014).
- Hassan, S., van Dolleweerd, C. J., Ioakeimidis, F., Keshavarz-Moore, E., Ma, J. K. Considerations for extraction of monoclonal antibodies targeted to different subcellular compartments in transgenic tobacco plants. Plant Biotechnol. J. 6, 733-748 (2008).
- Arfi, Z. A., Drossard, J., Hellwig, S., Fischer, R., Buyel, J. F. Polyclonal antibodies can effectively detect tobacco host cell proteins after RuBisCO depletion and endotoxin removal. Biotechnol. J. , (2015).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochem. Eng. J. 88, 162-170 (2014).
- Buyel, J. F., Fischer, R. A juice extractor can simplify the downstream processing of plant-derived biopharmaceutical proteins compared to blade-based homogenizers. Process Biochem. 50, 859-866 (2014).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Ma, J. K., et al. Regulatory approval and a first-in-human phase I clinical trial of a monoclonal antibody produced in transgenic tobacco plants. Plant Biotechnol. J. 13, 1106-1120 (2015).
- Mahajan, P. V., Caleb, O. J., Singh, Z., Watkins, C. B., Geyer, M. Postharvest treatments of fresh produce. Philos T R Soc A. 372, (2014).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Fischer, R. Characterization of complex systems using the design of experiments approach: transient protein expression in tobacco as a case study. J. Vis. Exp. , e51216 (2014).
- Buyel, J. F. Procedure to evaluate the efficiency of flocculants for the removal of dispersed particles from plant extracts. J. Vis. Exp. , e53940 (2016).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Curr. Protoc. Mol. Biol. 76, (2006).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnol. Bioeng. 110, 471-482 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods Mol. Biol. 503, 65-88 (2009).
- Kim, T. D., Ryu, H. J., Cho, H. I., Yang, C. H., Kim, J. Thermal behavior of proteins: Heat-resistant proteins and their heat-induced secondary structural changes. Biochemistry-Us. 39, 14839-14846 (2000).
- Kwon, S., Jung, Y., Lim, D. Proteomic analysis of heat-stable proteins in Escherichia coli. Bmb Rep. 41, 108-111 (2008).
- Komarnytsky, S., Borisjuk, N. V., Borisjuk, L. G., Alam, M. Z., Raskin, I. Production of recombinant proteins in tobacco guttation fluid. Plant Physiol. 124, 927-933 (2000).
- Drake, P. M. W., et al. Development of rhizosecretion as a production system for recombinant proteins from hydroponic cultivated tobacco. FASEB J. 23, 3581-3589 (2009).
- Turpen, T. H. Tobacco mosaic virus and the virescence of biotechnology. Philos. Trans. R. Soc. Lond., Ser. B: Biol. Sci. 354, 665-673 (1999).
- Kingsbury, N. J., McDonald, K. A. Quantitative Evaluation of E1 Endoglucanase Recovery from Tobacco Leaves Using the Vacuum Infiltration-Centrifugation Method. Biomed. Res. Int. , (2014).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Mandal, M. K., Fischer, R., Schillberg, S., Schiermeyer, A. Inhibition of protease activity by antisense RNA improves recombinant protein production in Nicotiana tabacum cv. Bright Yellow 2 (BY-2) suspension cells. Biotechnol. J. 9, 1065-1073 (2014).
- Welty, J. R., Wicks, C. E., Wilson, R. E. . Fundamentals of momentum, heat, and mass transfer. , (1976).
- Lowe, D., et al. Aggregation, stability, and formulation of human antibody therapeutics. Advances in protein chemistry and structural biology. 84, 41-61 (2011).
- Gong, R., et al. Engineered human antibody constant domains with increased stability. J. Biol. Chem. 284, 14203-14210 (2009).
- Rouet, R., Lowe, D., Christ, D. Stability engineering of the human antibody repertoire. FEBS Lett. 588, 269-277 (2014).
- Stabel, J. R., Lambertz, A. Efficacy of pasteurization conditions for the inactivation of Mycobacterium avium subsp paratuberculosis in milk. J. Food Prot. 67, 2719-2726 (2004).
- Wichers, H., Mills, C., Wichers, H., Hoffmann-Sommergruber, K. Ch. 12. Managing Allergens in Food. , 336 (2006).
- Davis, P. J., Williams, S. C. Protein modification by thermal processing. Allergy. 53, 102-105 (1998).
- Dubois, M. F., Hovanessian, A. G., Bensaude, O. Heat-shock-induced denaturation of proteins. Characterization of the insolubilization of the interferon-induced p68 kinase. J. Biol. Chem. 266, 9707-9711 (1991).

