신호 전달 단백질의 기능을 흉내 낸 : 인공 신호 전달 요법을 향해
Summary
We present guidelines for developing synthetic ‘chemical transducers’ that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific ‘transducer’ that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell’s function. We present guidelines for designing ‘chemical transducers’ that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific ‘transducer’, which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in ‘artificial signal transduction therapy’. This work is intended to facilitate developing additional ‘transducers’ of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
신호 전달 경로는 거의 모든 세포 과정에 중요한 역할을 담당하고, 셀이 급속히 환경 신호에 응답 할 수있다. (1)이 경로는 종종 세포 내 효소의 활성 결과 세포 외 수용체에 시그널링 분자의 결합에 의해 유발된다. 증폭 및 세포 내 신호 전달이 효소는 높은 특이성을 가역적으로 활성화되는 단백질 – 단백질 상호 작용의 네트워크를 형성하는 신호 전달 단백질의 작용에 의해 매개된다. 이러한 네트워크의 조절 곤란 자주 암 발생을 유도하기 때문에, 약물 악성 신호 전달 경로를 방해하도록 설계된다 '암 신호 전달 요법'이 확립에 많은 관심이 있었다. 최근 부자연 신호 전달 경로를 생성하는 약물의 능력에 의존하여 전달 요법을 알리기 위해 다른 방법을 제안 하였다. <su특히 p> 3, 우리는 신호 전달 단백질의 작용을 모방 합성 제제를 설계함으로써, 간접적으로 세포의 기능을 조절하는 것이 가능하다고 판단된다. 예를 들어, 이들 네트워크는 인공 드럭을 절단하는 효소를 활성화하는 생체 단백질을 가능하게 할 수있다. 또한, 이러한 신호 전달 단백질 모방 체는 치료 효과의 결과로, 자연스러운 세포 신호 전달 경로를 활성화 할 수 있습니다.
이러한 접근의 가능성을 증명하기 위해, 최근 인 글루타치온 에스 – 트랜스퍼 라제 (GST)를 활성화시켜 항암 전구 약물의 분해를 유발 혈소판 유래 성장 인자 (PDGF)를 가능하게하는 합성 '화학 변환기'4 작성한 하지 자연 바인딩 파트너. 이 '변환기'의 구조에 대한 GST 가의 억제제 수정 항 PDGF의 DNA 앱 타머 구성된다. 따라서,이 합성 에이전트에 결합 부위와 분자의 가족에 속하는다른 단백질, 이량의 5-7와 같은 화학 유도 (식별자) 8 ~ 10도 올리고 뉴클레오티드 합성 분자 복합체를 기반으로 단백질 바인더의 그룹. 11-21
이러한 시스템의 설계의 기초가되는 일반적인 원리는 본 명세서에 기술되고 합성 종래 효소 분석법이 '변환기'의 기능을 테스트하기위한 상세한 프로토콜이 제공된다. 이 작업은 세포 단백질 간의 통신을 매개하고, 따라서, 인공 세포 신호 전달 경로를 유도하는 데 사용될 수있다,이 클래스의 추가적인 '센서'를 개발 촉진하기위한 것이다.
도 1은 비 천연 단백질 간의 통신을 매개 할 수있는 합성 '화학 센서'의 동작 원리를 설명한다. 제자를위한 합성 바인더 통합이 그림은 '화학 센서'에서고용주 식별 번호 (EIN) I 및 II (바인더 I 및 II)는 자연 바인딩 파트너가 아닌 단백질의 촉매 활성 I를 트리거하는 단백질 II 수 있습니다. II 단백질의 부재에서, 변환기는 효소 (단백질 I)의 촉매 사이트를 결합하고 그 활성 (도 1의 상태 II)를 억제한다. 단백질 II의 '변환기'결합, 단, 그 결과의 유효 농도를 단백질 I. 향해 친화력을 감소 바인더 I 단백질 II의 표면 (도 1의 상태 ⅲ) 사이의 상호 작용을 촉진 ' 솔루션 무료 '트랜스 듀서는 트랜스 듀서 단백질의 해리 리드하는 감소 I 복잡하고 단백질 I의 재 활성화에 (그림 1, 상태 ⅳ). (1) '변환기', 단백질 목표의 각각에 대해 (2) 상호 작용 betwe을 특정 바인더가 있어야합니다 함께 다음 단계는 효율적인 '변환기'의 디자인을 기본 세 가지 기본 원칙을 강조바인더 II 단백질 엉 II 내가 단백질 II의 표면과 상호 작용 할 수 있어야 바인더 I 단백질 I, (3) 바인더 사이의 상호 작용보다 더 강한해야합니다. 이 마지막 원칙은 반드시 단백질 II 향해 높은 친화력 및 선택성을해야 내가 혼자 바인더를 필요로하지 않습니다. 대신, 단백질에 근접 합성 분자를 가져 오는 것은,이 단백질 분자의 표면 사이의 상호 작용을 촉진 할 가능성이 있음을 보여 우리의 최근의 연구에 기초한다. 19,22,23
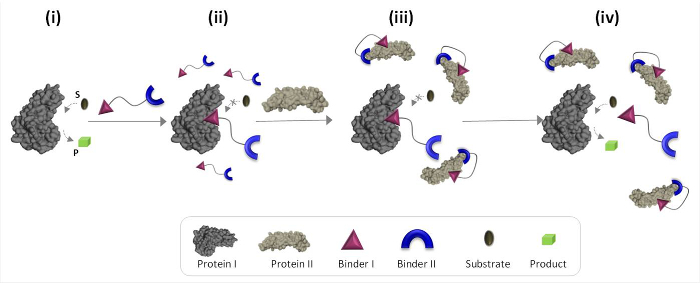
그림 1 :. '화학 트랜스 듀서는'활성 단백질 I (상태 I)에 추가 될 때 '화학 센서'의 작동 원리, 그것은 바인더를 통해 활성 부위에 I를 결합하여 그 활성 (주 II)를 억제한다. II 단백질의 존재하지만, 결합되지 않은 "화학 transducer '는 바인더 I 단백질 II의 표면 사이의 상호 작용을 촉진 바인더 II를 통해 단백질 II와 상호 작용합니다. 이 유도 바인더 I-단백질 II 상호 작용은 내가 복잡하고 단백질에 내가 재 활성화 (상태 IV). 'transducer' 단백질의 해리 리드 바인더 I의 유효 농도를 감소 여기를 클릭하십시오이 그림의 더 큰 버전을 볼 수 .
Protocol
Representative Results
Discussion
We presented a method for designing and testing of a ‘chemical transducer’ that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the ‘chemical transducer’ and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 연구는 미네르바 재단, HFSP 조직 및 유럽 연구위원회 그랜트에 의해 지원되었다 (부여 338265 시작).
Materials
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
Riferimenti
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, ‘turn-on’ fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochimica. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).

