Ligne Funksjon Melde Proteiner: Mot Kunstig signaltransduksjon Therapy
Summary
We present guidelines for developing synthetic ‘chemical transducers’ that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific ‘transducer’ that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell’s function. We present guidelines for designing ‘chemical transducers’ that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific ‘transducer’, which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in ‘artificial signal transduction therapy’. This work is intended to facilitate developing additional ‘transducers’ of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
Signaltransduksjonsveier spille en betydelig rolle i praktisk talt alle cellulære prosessen og tillate cellen å reagere raskt på miljøsignaler. 1. Disse banene ofte utløses ved binding av et signalmolekyl til en ekstracellulær reseptor, noe som resulterer i aktivering av intracellulære enzymer. Amplifisering og forplantning av dette signal i cellen er formidlet ved funksjon av signaleringsproteiner som danner et nettverk av protein-protein interaksjoner hvori enzymene er reversibelt aktivert med høy spesifisitet. På grunn dysregulering av disse nettverkene ofte fører til kreftutvikling, har det vært stor interesse for å etablere 'signaltransduksjon terapi av kreft', 2 hvorved medikamenter er utviklet for å forstyrre maligne signalveier. Vi har nylig foreslått en alternativ tilnærming til signaltransduksjon terapi som er avhengig av evnen til medikamenter for å generere unaturlige signaltransduksjonsveier. <sup> 3 I særdeleshet, tror vi at ved å utforme syntetiske stoffer som etterligner funksjon av signaliseringsproteiner, ville det være mulig å modulere cellens funksjon indirekte. For eksempel kan disse kunstige nettverk gjør det mulig protein biomarkører for å aktivere enzymer som spalter forløpere. Alternativt kan disse signal protein-mimetika være i stand til å aktivere unaturlige cellesignalbaner, noe som resulterer i terapeutiske effekter.
For å demonstrere gjennomførbarheten av denne tilnærmingen, har vi nylig opprettet et syntetisk "kjemiske transduser '4 som gjør det mulig blodplateavledet vekstfaktor (PDGF) for å utløse den spaltning av et anticancer prodrug ved aktivering av glutation-s-transferase (GST), som er ikke sin naturlige bindende partner. Strukturen av denne "transduser" består av et anti-PDGF-DNA aptamer som er modifisert med en bivalent inhibitor for GST. Således tilhører denne syntesemiddel til en familie av molekyler med bindingsseter for åforskjellige proteiner, 5-7 eksempel kjemiske indusere av dimerization (KBS) 8-10 og også til gruppen av protein-bindemidler basert på oligonukleotid-syntetisk molekyl konjugater. 11-21
De generelle prinsipper som ligger til grunn for utformingen av slike systemer er beskrevet her, og detaljerte protokoller for syntetisering og teste funksjonen av denne "transduser" med konvensjonelle enzymatiske analysene er gitt. Dette arbeidet er ment å forenkle utviklingen av flere transdusere '' av denne klasse som kan brukes til å formidle intracellulært protein-protein-kommunikasjon og følgelig, for å indusere kunstig celle signalveier.
Figur 1 beskriver skjematisk drifts prinsippene for syntetisk 'kjemiske transdusere "som kan megle unaturlig protein-protein kommunikasjon. I denne illustrasjonen et "kjemisk transduser ', som integrerer syntetiske bindemidler for proteins I og II (bindemidler I og II), gjør det mulig for protein II for å utløse den katalytiske aktivitet av protein I, som ikke er dens naturlig bindingspartner. I fravær av protein II, binder transduceren det katalytiske sete i enzymet (protein I) og inhiberer dets aktivitet (figur 1, tilstand ii). Bindingen av den "transduser" til protein II, men fremmer interaksjon mellom bindemiddel I og overflaten av proteinet II (figur 1, tilstand iii), noe som reduserer dens affinitet overfor protein I. Som et resultat av den effektive konsentrasjonen av ' fri 'transduser i oppløsningen er redusert, noe som fører til dissosiasjon av transduseren-protein i-komplekset og til reaktivering av protein i (Figur 1, tilstand iv). Samlet utgjør disse trinnene frem tre grunnleggende prinsipper for utforming av effektive 'transdusere': (1) en "svinger" skal ha en bestemt bindemiddel for hver av protein mål, (2) samspillet betweno bindemiddel II og protein II skal være sterkere enn vekselvirkningen mellom bindemiddel I og protein I, og (3) bindemiddel I må være i stand til å samhandle med overflaten av proteinet II. Dette siste prinsippet ikke nødvendigvis krever at bindemidlet jeg alene ville ha en høy affinitet og selektivitet overfor protein II. I stedet er det basert på vår nylige studier som viste at bringe et syntetisk molekyl i tilknytning til et protein som er egnet til å fremme interaksjon mellom dette molekylet og overflaten av proteinet. 19,22,23
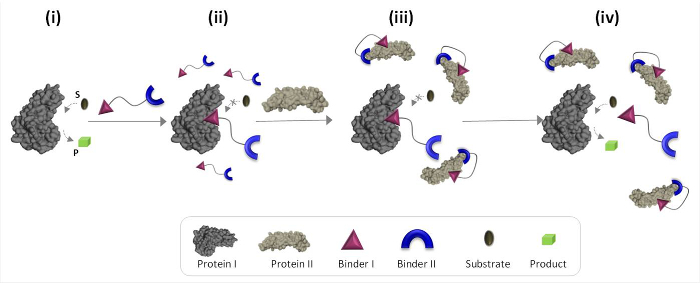
Fig. 1: Drifts prinsipper 'kjemiske transdusere' Når den "kjemiske transduseren 'tilsettes til et aktivt protein I (tilstand i), bindes det til dets aktive sete gjennom bindemiddel I og inhiberer dets aktivitet (tilstand II). I nærvær av protein II, men det ubundne 'kjemisk transducer 'samvirker med protein II gjennom bindemiddel II, som fremmer interaksjon mellom bindemiddel I og overflaten av proteinet II. Dette indusert bindemiddel I-protein II interaksjon reduserer den effektive konsentrasjonen av bindemiddel jeg, noe som fører til dissosiasjon av "transducer'-protein jeg kompleks og protein jeg reaktive (stat iv). Klikk her for å se en større versjon av dette tallet .
Protocol
Representative Results
Discussion
We presented a method for designing and testing of a ‘chemical transducer’ that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the ‘chemical transducer’ and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Denne forskningen ble støttet av Minerva Foundation, HFSP Organization, og en European Research Council Grant (Starting Grant 338265).
Materials
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
Riferimenti
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, ‘turn-on’ fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochimica. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).

