Imitando a Função de Proteínas de Sinalização: Toward Artificial Signal Therapy Transdução
Summary
We present guidelines for developing synthetic ‘chemical transducers’ that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific ‘transducer’ that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell’s function. We present guidelines for designing ‘chemical transducers’ that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific ‘transducer’, which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in ‘artificial signal transduction therapy’. This work is intended to facilitate developing additional ‘transducers’ of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
Vias de transdução de sinal de desempenhar um papel significativo em virtualmente todos os processos celulares e permitir que a célula para responder rapidamente aos sinais ambientais. 1 Estas vias são frequentemente desencadeada pela ligação de uma molécula de sinalização a um receptor extracelular, o que resulta na activação de enzimas intracelulares. A amplificação e a propagação deste sinal dentro da célula é mediada pela função de sinalização de proteínas que formam uma rede de interacções proteína-proteína, em que as enzimas são activadas de forma reversível com alta especificidade. Porque desregulação destas redes freqüentemente leva ao desenvolvimento do câncer, tem havido muito interesse no estabelecimento de "terapia de transdução de sinal do câncer ', 2 em que as drogas são projetados para interromper vias de sinalização malignas. Propusemos recentemente uma abordagem alternativa terapia para assinalar a transdução que se baseia na capacidade das drogas para gerar vias de transdução de sinal não naturais. <sup> 3 em particular, acreditamos que através da concepção de agentes sintéticos que mimetizam a função das proteínas de sinalização, seria possível modular a função da célula indirectamente. Por exemplo, estas redes artificiais podem activar proteínas biomarcadores para activar enzimas que clivam pró-fármacos. Alternativamente, estes miméticos de proteínas de sinalização pode ser capaz de activar as vias de sinalização de células não-naturais, o que resulta em efeitos terapêuticos.
Para demonstrar a viabilidade desta abordagem, criámos recentemente um transdutor química "sintético 4, que permite que o factor de crescimento derivado de plaquetas (PDGF), para desencadear a clivagem de um pró-fármaco anticanceroso, activando a glutationa-S-transferase (GST), que é não o seu parceiro de ligação natural. A estrutura deste "transdutor" consiste em um aptâmero ADN anti-PDGF que é modificado com um inibidor bivalente para GST. Por isso, este agente sintético pertence a uma família de moléculas com locais de ligação paraproteínas diferentes, 5-7, tais como indutores químicos de dimerização (CIDs) 8-10 e também para o grupo de proteína de ligantes com base em conjugados de molécula oligonucleotídica-sintético. 21/11
Os princípios gerais da concepção de tais sistemas é aqui descrito e protocolos detalhados para sintetizar e testar a função deste "transdutor" com ensaios enzimáticos convencionais são fornecidos. Este trabalho destina-se a facilitar o desenvolvimento de transdutores '' adicionais desta classe, que pode ser usado para mediar a comunicação proteína-proteína intracelular e, consequentemente, para induzir vias de sinalização celular artificiais.
A Figura 1 descreve esquematicamente os princípios de funcionamento dos transdutores '' químicos sintéticos que podem mediar a comunicação proteína-proteína não naturais. Nesta ilustração, um transdutor química ", que integra ligantes sintéticos para protEins I e II (ligantes I e II), permite que a proteína II para desencadear a actividade catalítica da proteína I, que não é o seu parceiro de ligação natural. Na ausência de proteína II, o transdutor se liga ao sítio catalítico da enzima (proteína I) e inibe a sua actividade (Figura 1, no estado II). A ligação do "transdutor" de proteína II, no entanto, promove as interacções entre ligante I e a superfície da proteína II (Figura 1, no estado III), o que reduz a sua afinidade para a proteína I. Como resultado, a concentração eficaz do ' livre transdutor 'na solução é reduzida, o que conduz à dissociação do transdutor em proteínas do complexo I e a reactivação da proteína I (Figura 1, estado IV). Tomados em conjunto, estes passos destacar três princípios fundamentais subjacentes à concepção de transdutores '' eficazes: (1) um transdutor 'deve ter um ligante específico para cada um dos alvos de proteína, (2) a interacção between ligante II e proteína II deve ser mais forte do que a interacção entre o ligante I e proteína I, e (3) agente ligante que deve ser capaz de interagir com a superfície da proteína II. Este último princípio não exige necessariamente que aglutinante só eu teria uma alta afinidade e selectividade para a proteína II. Em vez disso, baseia-se nos nossos estudos recentes que mostraram que a interposição de uma molécula sintética na proximidade de uma proteína é susceptível de promover interacções entre esta molécula e a superfície da proteína 19,22,23.
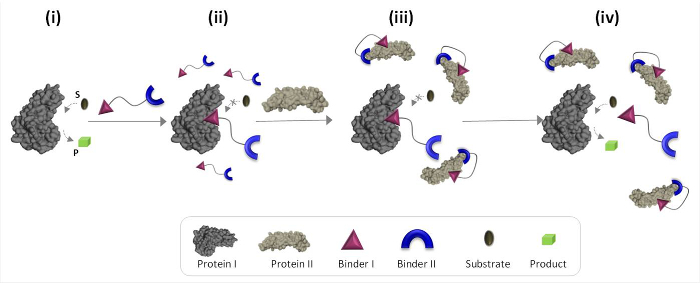
Figura 1:. Operando princípios da 'transdutores químicas "Quando o' transdutor química 'é adicionada a uma proteína ativa I (estado i), que se liga ao seu sítio ativo através ligante I e inibe a sua actividade (estado ii). Na presença da proteína II, no entanto, não ligado a 't químicaransducer 'interage com a proteína II por meio de ligante II, que promove as interacções entre ligante I e a superfície da proteína II. Esta pasta induzida I-proteína interação II reduz a concentração eficaz de ligante I, o que leva à dissociação do 'transducer'-proteína I complexa e à proteína I reactivação (estado iv). Por favor clique aqui para ver uma versão maior desta figura .
Protocol
Representative Results
Discussion
We presented a method for designing and testing of a ‘chemical transducer’ that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the ‘chemical transducer’ and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Esta pesquisa foi apoiada pela Fundação Minerva, a Organização HFSP e um Grant Conselho Europeu de Investigação (Começando Grant 338265).
Materials
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
Riferimenti
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, ‘turn-on’ fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochimica. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).

