Sinyal Proteinlerin Fonksiyonu taklit: Yapay Sinyal İletimi Tedavisi Doğru
Summary
We present guidelines for developing synthetic ‘chemical transducers’ that can induce communication between naturally unrelated proteins. In addition, detailed protocols are presented for synthesizing and testing a specific ‘transducer’ that enables a growth factor to activate a detoxifying enzyme and consequently, to regulate the cleavage of an anticancer prodrug.
Abstract
Signal transduction pathways, which control the response of cells to various environmental signals, are mediated by the function of signaling proteins that interact with each other and activate one other with high specificity. Synthetic agents that mimic the function of these proteins might therefore be used to generate unnatural signal transduction steps and consequently, alter the cell’s function. We present guidelines for designing ‘chemical transducers’ that can induce artificial communication between native proteins. In addition, we present detailed protocols for synthesizing and testing a specific ‘transducer’, which can induce communication between two unrelated proteins: platelet-derived growth-factor (PDGF) and glutathione-S-transferase (GST). The way by which this unnatural PDGF-GST communication could be used to control the cleavage of an anticancer prodrug is also presented, indicating the potential for using such systems in ‘artificial signal transduction therapy’. This work is intended to facilitate developing additional ‘transducers’ of this class, which may be used to mediate intracellular protein-protein communication and consequently, to induce artificial cell signaling pathways.
Introduction
Sinyal transdüksiyon yollarının hemen hemen her türlü hücresel işlemde önemli bir rol oynamaktadır ve hücre hızlı çevresel sinyallere cevap verir. 1. Bu yollar sık sık, hücre içi enzimlerin aktivasyonu ile sonuçlanır hücre dışı bir reseptör, bir sinyal molekülünün bağlanması ile tetiklenir. Amplifikasyon ve hücre içinde, bu sinyalin yayılma enzimleri tersine çevrilebilir yüksek özgüllük ile aktive olan protein-protein etkileşimleri, bir ağ oluşturmak proteinlerin sinyal fonksiyonunun aracılık eder. Bu ağların düzensizliği sık kanser gelişimine yol açar, çünkü uyuşturucu malign sinyal yolları bozmak için tasarlanmış bu sayede 'kanser sinyal iletim tedavisi', 2 kurulmasında çok ilgi olmuştur. Biz son zamanlarda doğal olmayan sinyal iletim yollarını oluşturmak için ilaçların yeteneklerine bağlıdır iletim tedavisi sinyal alternatif bir yaklaşım önerdi. <suÖzellikle p> 3 biz sinyal proteinlerinin fonksiyonunu taklit eden sentetik maddeler tasarlayarak, dolaylı hücrenin fonksiyonunu modüle etmek mümkün olacağı düşünülmektedir. Örneğin, bu yapay ağlar ön ilaçlarını bölen enzimleri aktive protein biyobelirteçlerini sağlayabilir. Alternatif olarak, bu sinyal protein taklitleri terapötik etkilere neden doğal olmayan hücre sinyal yolları aktive mümkün olabilir.
Bu yaklaşımın uygulanabilirliğini göstermek için, son zamanlarda bir glutatyon-S-transferaz (GST), aktive ederek bir antikanser ön ilacın bölünmesini tetiklemek için, trombosit türevli büyüme faktörü (PDGF) sağlayan sentetik bir "Kimyasal transdüser '4 oluşturduk değil doğal bağlama ortağı. Bu 'transdüktörün' yapısı GST için bir iki değerli önleyici ile modifiye edilmiş bir anti-PDGF DNA aptamer oluşur. Bu nedenle, bu sentetik madde için bağlanma yerleri bir molekül ailesine aitFarklı proteinler, dimerizasyonunun 5-7 gibi kimyasal uyarıcılar (Müşteri Kimlikleri) 8-10 ve oligonükleotid-sentetik bir molekül konjugatlarının göre protein bağlayıcı grup. 11-21
Bu tür sistemlerin tasarımını temel genel ilkeleri burada tarif edildiği ve sentezlemek ve konvansiyonel enzimatik deneyleri ile bu 'transdüser' fonksiyonunu test etmek için ayrıntılı protokoller sağlanır. Bu çalışma, hücre içi protein-protein iletişim aracılık etmek ve bunun sonucu olarak, yapay hücre sinyalizasyon yolları uyarılması için kullanılabilecektir Bu sınıf, ilave 'dönüştürücüleri' geliştirilmesinin kolaylaştırılması için tasarlanmıştır.
Şekil 1 doğal olmayan protein-protein iletişimi aracılık sentetik 'kimyasal dönüştürücüler' çalışma prensiplerini açıklar. prot için sentetik bağlayıcı entegre Bu resimde, bir 'kimyasal transdüser' inEins I ve II (bağlayıcı I ve II), doğal bağlanma ortağı olmayan proteinin katalitik aktivitesi I tetiklemek için protein II sağlar. Protein II yokluğunda, dönüştürücü enzimi (protein I) 'e katalitik bağlayan ve aktivitesi (Şekil 1, durumu ii) inhibe eder. Protein II 'transdüktörün' bağlanmasının, ancak, bunun bir sonucu olarak etkili konsantrasyonunu proteini I'e doğru yakınlığını azaltır bağlayıcı I ve protein II yüzeyi (Şekil 1, konum III), arasındaki etkileşimi teşvik ' çözelti içinde serbest 'dönüştürücü transformatör-protein ayrışmasına yol açan azaltılır karmaşık ve protein ı yeniden aktive etmek (Şekil 1, durumu iv). (1) 'dönüştürücü', protein hedeflerinin her biri için (2) etkileşim betwe belirli bir bağlayıcı olmalıdır: Birlikte ele alındığında, bu adımlar verimli 'dönüştürücüler' tasarımı altında yatan üç temel ilkeleri vurgulamakbağlayıcı II ve protein tr II Ben protein II yüzeyi ile etkileşim mümkün olmalıdır bağlayıcı I ve protein I ve (3) bağlayıcı arasındaki etkileşim daha güçlü olmalıdır. Bu son prensibi mutlaka protein II doğru yüksek bir afiniteye ve seçimliliğe sahip olur yalnız bu bağlayıcı gerekli değildir. Bunun yerine, bir proteine denk gelen sentetik bir molekül getiren bu molekülün ve protein yüzeyi arasındaki etkileşimi teşvik etmek için olası olduğunu göstermiştir son çalışmalara dayanmaktadır. 19,22,23
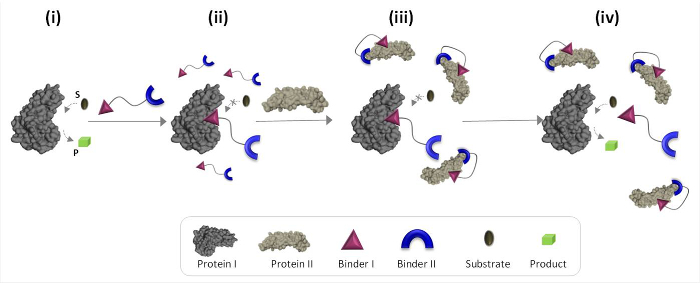
Şekil 1:. 'Kimyasal dönüştürücü' aktif protein I (devlet i) eklendiğinde 'kimyasal dönüştürücüler' ve Çalışma prensipleri, bu bağlayıcı aracılığıyla aktif sitesine I bağlanır ve faaliyetlerini (devlet ii) inhibe eder. protein II varlığında, ancak, bağlanmamış "Kimyasal transducer 'bağlayıcı I ve protein II yüzeyi arasındaki etkileşimi teşvik bağlayıcı II yoluyla protein II ile etkileşir. Bu uyarılmış bağlayıcı I-protein II etkileşimi Ben karmaşık ve proteine ben etkinleştirme (devlet iv). 'Transducer'-protein ayrışmasına yol açar bağlayıcı I etkili konsantrasyonunu azaltır tıklayınız Bu rakamın büyük bir versiyonunu görmek için .
Protocol
Representative Results
Discussion
We presented a method for designing and testing of a ‘chemical transducer’ that can induce artificial communication between two naturally unrelated proteins, GST and PDGF, without modifying the native proteins. The unnatural GST-PDGF communications could be detected in real time by using enzymatic assays that follow the changes in the activity of GST in the presence of the ‘chemical transducer’ and increasing the concentrations of PDGF. In addition to detecting the activation of GST by PDGF, these assays were used to fol…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Bu araştırma Minerva Vakfı, HFSP Örgütü ve Avrupa Araştırma Konseyi Grant tarafından desteklenmiştir (Grant 338265 Başlangıç).
Materials
| 1-chloro-2,4-dinitrobenzene | Sigma-Aldrich | 237329 | |
| Acetic acid | Bio Lab | 01070521 | |
| Acetnitrile | J.T.Baker | 9017-03 | |
| Ascorbic acid | Sigma-Aldrich | A4544 | |
| Copper(II) Sulfate pentahydrate | Merck-Millipore | 102790 | |
| Dimethyl sulfoxide | Merck-Millipore | 802912 | |
| Dulbecco's Phosphate Buffered Saline | Biological Industries | 02-023-5A | |
| Ethacrynic acid | Tokyo Chemical Industry Co. Ltd | E0526 | |
| Glutathione-s-transferase M1-1 | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| JS-K | Sigma-Aldrich | J4137 | |
| L-glutathione reduced | Sigma-Aldrich | G4251 | |
| Magnesium Chloride | J.T.Baker | 0162 | |
| nitrate/nitrite colorimetric assay kit | Cayman Chemical | 780001 | |
| Oligonucleotides | W. M. Keck Foundation Biotechnology at Yale University | custom order | |
| PDGF-BB | Israel Structural Proteomics Center (Weizmann Institute of Science, Rehovot, Israel) | ||
| TBTA | Sigma-Aldrich | 678937 | |
| Triethylamine | Sigma-Aldrich | T0886 | |
| Desalting column | GE Healthcare | illustra MicroSpin G-25 Columns | |
| HPLC | Waters | 2695 separation module | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5 μM, 4.6 mm × 50 mm) | |
| HPLC column | Waters | XBridgeTM OST C18 column (2.5μM, 10 mm × 50 mm) | |
| Plate reader | BioTek | synergy H4 hybrid |
Riferimenti
- Hunter, T. Signaling—2000 and Beyond. Cell. 100, 113-127 (2000).
- Levitzki, A., Klein, S. Signal transduction therapy of cancer. Mol Aspects Med. 31, 287-329 (2010).
- Peri-Naor, R., Motiei, L., Margulies, D. Artificial signal transduction therapy: a futuristic approach to disease treatment. Future Med. Chem. 7, 2091-2093 (2015).
- Peri-Naor, R., Ilani, T., Motiei, L., Margulies, D. Protein-Protein Communication and Enzyme Activation Mediated by a Synthetic Chemical Transducer. J. Am. Chem. Soc. 137, 9507-9510 (2015).
- Corson, T. W., Aberle, N., Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem. Biol. 3, 677-692 (2008).
- Rutkowska, A., Schultz, C. Protein Tango: The Toolbox to Capture Interacting Partners. Angew. Chem. Int. Ed. 51, 8166-8176 (2012).
- Meyer, C., Köhn, M. A Molecular Tête-à-Tête Arranged by a Designed Adaptor Protein. Angew. Chem. Int. Ed. 51, 8160-8162 (2012).
- Klemm, J. D., Schreiber, S. L., Crabtree, G. R. Dimerization as a Regulatory Mechanism in Signal Transduction. Annu. Rev. Immunol. 16, 569-592 (1998).
- DeRose, R., Miyamoto, T., Inoue, T. Manipulating signaling at will: chemically-inducible dimerization (CID) techniques resolve problems in cell biology. Pflugers Arch. 465, 409-417 (2013).
- Gestwicki, J. E., Marinec, P. S. Chemical control over protein-protein interactions: beyond inhibitors. Comb. Chem. High Throughput. Screen. 10, 667-675 (2007).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. 25, 848-862 (2013).
- Diezmann, F., Seitz, O. DNA-guided display of proteins and protein ligands for the interrogation of biology. Chem. Soc. Rev. 40, 5789-5801 (2011).
- Röglin, L., Ahmadian, M. R., Seitz, O. DNA-Controlled Reversible Switching of Peptide Conformation and Bioactivity. Angew. Chem. Int. Ed. 46, 2704-2707 (2007).
- Röglin, L., Altenbrunn, F., Seitz, O. DNA and RNA-Controlled Switching of Protein Kinase Activity. ChemBioChem. 10, 758-765 (2009).
- Harris, D. C., Chu, X., Jayawickramarajah, J. DNA-Small Molecule Chimera with Responsive Protein-Binding Ability. J. Am. Chem. Soc. 130, 14950-14951 (2008).
- Harris, D. C., Saks, B. R., Jayawickramarajah, J. Protein-Binding Molecular Switches via Host-Guest Stabilized DNA Hairpins. J. Am. Chem. Soc. 133, 7676-7679 (2011).
- Kim, Y., Cao, Z., Tan, W. Molecular assembly for high-performance bivalent nucleic acid inhibitor. Proc. Nat. Acad. Sci. U.S.A. 105, 5664-5669 (2008).
- Han, D., et al. A Logical Molecular Circuit for Programmable and Autonomous Regulation of Protein Activity Using DNA Aptamer-Protein Interactions. J. Am. Chem. Soc. 134, 20797-20804 (2012).
- Motiei, L., Pode, Z., Koganitsky, A., Margulies, D. Targeted Protein Surface Sensors as a Tool for Analyzing Small Populations of Proteins in Biological Mixtures. Angew. Chem. Int. Ed. 53, 9289-9293 (2014).
- Ranallo, S., Rossetti, M., Plaxco, K. W., Vallée-Bélisle, A., Ricci, F. A Modular, DNA-Based Beacon for Single-Step Fluorescence Detection of Antibodies and Other Proteins. Angew. Chem. Int. Ed. 54, 13214-13218 (2015).
- Franzini, R. M., et al. Identification of Structure-Activity Relationships from Screening a Structurally Compact DNA-Encoded Chemical Library. Angew. Chem. Int. Ed. 54, 3927-3931 (2015).
- Unger-Angel, L., et al. Protein recognition by bivalent, ‘turn-on’ fluorescent molecular probes. Chem. Sci. 6, 5419-5425 (2015).
- Nissinkorn, Y., et al. Sensing Protein Surfaces with Targeted Fluorescent Receptors. Chem. Eur. J. 21, 15981-15987 (2015).
- Huber, C. G., Oefner, P. J., Bonn, G. K. High-Resolution Liquid Chromatography of Oligonucleotides on Nonporous Alkylated Styrene-Divinylbenzene Copolymers. Anal. Biochem. 212, 351-358 (1993).
- Lyon, R. P., Hill, J. J., Atkins, W. M. Novel class of bivalent glutathione S-transferase inhibitors. Biochimica. 42, 10418-10428 (2003).
- Battle, C., Chu, X., Jayawickramarajah, J. Oligonucleotide-based systems for input-controlled and non-covalently regulated protein binding. Supramol. Chem. , 1-16 (2013).

