Die Synthese von RGD-funktionalisierten Hydrogele als Werkzeug für therapeutische Anwendungen
Summary
We present a protocol for the synthesis of RGD-functionalized hydrogels as devices for cell and drug delivery. The procedure involves copper catalyzed alkyne-azide cycloaddition (CuAAC) between alkyne-modified polyacrylic acid (PAA) and a RGD-azide derivative. The hydrogels are formed using microwave-assisted polycondensation and their physicochemical properties are investigated.
Abstract
The use of polymers as biomaterials has provided significant advantages in therapeutic applications. In particular, the possibility to modify and functionalize polymer chains with compounds that are able to improve biocompatibility, mechanical properties, or cell viability allows the design of novel materials to meet new challenges in the biomedical field. With the polymer functionalization strategies, click chemistry is a powerful tool to improve cell-compatibility and drug delivery properties of polymeric devices. Similarly, the fundamental need of biomedicine to use sterile tools to avoid potential adverse-side effects, such as toxicity or contamination of the biological environment, gives rise to increasing interest in the microwave-assisted strategy.
The combination of click chemistry and the microwave-assisted method is suitable to produce biocompatible hydrogels with desired functionalities and improved performances in biomedical applications. This work aims to synthesize RGD-functionalized hydrogels. RGD (arginylglycylaspartic acid) is a tripeptide that can mimic cell adhesion proteins and bind to cell-surface receptors, creating a hospitable microenvironment for cells within the 3D polymeric network of the hydrogels. RGD functionalization occurs through Huisgen 1,3-dipolar cycloaddition. Some PAA carboxyl groups are modified with an alkyne moiety, whereas RGD is functionalized with azido acid as the terminal residue of the peptide sequence. Finally, both products are used in a copper catalyzed click reaction to permanently link the peptide to PAA. This modified polymer is used with carbomer, agarose and polyethylene glycol (PEG) to synthesize a hydrogel matrix. The 3D structure is formed due to an esterification reaction involving carboxyl groups from PAA and carbomer and hydroxyl groups from agarose and PEG through microwave-assisted polycondensation. The efficiency of the gelation mechanism ensures a high degree of RGD functionalization. In addition, the procedure to load therapeutic compounds or biological tools within this functionalized network is very simple and reproducible.
Introduction
Hydrogele sind dreidimensionale Netzwerke durch hydrophile vernetzte Polymere gebildet werden, die natürlich oder synthetisch sind, und die durch eine ausgeprägte dreidimensionale Struktur aus. Diese Geräte sind zunehmend attraktiv in den biomedizinischen Bereichen Medikamentenabgabe, Tissue Engineering, Genträger und intelligente Sensoren 1,2. Tatsächlich ihres hohen Wassergehaltes sowie ihre rheologischen und mechanischen Eigenschaften machen sie geeignete Kandidaten Weichgewebe Mikroumgebungen zu imitieren und sie wirksame Werkzeuge für wasserlösliche Zytokin oder Wachstumsfaktor-Lieferung. Einer der vielversprechendsten ist die Verwendung als injizierbare Biomaterial Zellen und bioaktiven Verbindungen trägt. Hydrogele können das Überleben von Zellen und Kontrollstammzell Schicksal durch Halten und präzise Abgabe Stammzellregulationssignale in einer physiologisch relevanten Art und Weise verbessern, wie 3,4 di in vitro und in in vivo Experimenten beobachtet. Der führende Vorteil hierbei ist die Möglichkeit,injizierten Zellen innerhalb der Zone der Impfung (in situ), Minimierung der Menge an Zellen zu erhalten, die das Gebiet und Extravasate in den Kreis Strom verlässt, über den ganzen Körper der Migration und dem angestrebten Ziel 5 zu verlieren. Die Stabilität der dreidimensionalen Netzwerke Hydrogels ist aufgrund seiner Vernetzungsstellen, gebildet durch kovalente Bindungen oder Kohäsionskräfte zwischen den Polymerketten 6.
In diesem Rahmen angewendet orthogonal selektive Chemie an Polymerketten ist ein vielseitiges Werkzeug in der Lage 7 Hydrogel Leistungen zu verbessern. Tatsächlich könnte die Modifikation von Polymeren mit geeigneten chemischen Gruppen helfen, geeignete chemische, physikalische und mechanische Eigenschaften bereitzustellen Lebensfähigkeit der Zellen und deren Verwendung in der Gewebebildung zu verbessern. In gleicher Weise zu den Techniken Zellen oder Wachstumsfaktoren innerhalb der Gelmatrix, die Verwendung des RGD-Peptid ermöglicht Verbesserungen in der Zelladhäsion und das Überleben zu laden. RGD ist ein Tripeptid zusammengesetztvon Arginin, Glycin und Asparaginsäure, die bei weitem das wirksamste und oft eingesetzt Tripeptid aufgrund seiner Fähigkeit , mehr als eine Zelladhäsion – Rezeptor und seine biologische Wirkung auf die Zellverankerung, Verhalten und Überleben 8,9 zu adressieren ist. In dieser Arbeit wird die Synthese von RGD-funktionalisierten Hydrogele mit dem Ziel der Netzwerke durch ausreichende biochemische Eigenschaften für eine gastliche Zelle Mikro gekennzeichnet Gestaltung studiert.
Die Verwendung von Mikrowellenstrahlung in Hydrogel – Synthese bietet ein einfaches Verfahren , um Nebenreaktionen zu minimieren und höhere Reaktionsgeschwindigkeiten und Ausbeuten in kürzerer Zeit im Vergleich zu den herkömmlichen thermischen Verfahren 10 erhalten. Dieses Verfahren erfordert keine Reinigungsstufen und Ausbeuten sterile Hydrogele aufgrund der Wechselwirkungen der Polymere und der Abwesenheit eines organischen Lösungsmittels in dem Reaktionssystem 11. Daher gewährleistet es einen hohen Prozentsatz von RGD gebunden an das polymere Netzwerk, da kein modkationen werden den Polymer chemischen Gruppen erforderlich Gelbildung beteiligt. Carboxygruppen, von PAA und Carbomer, und Hydroxylgruppen von PEG und Agarose, führen zu dem Hydrogel dreidimensionale Struktur durch eine Polykondensationsreaktion. Die genannten Polymere werden für die Synthese von Hydrogelen in die Rückenmarksverletzung Reparaturbehandlungen 12 verwendet. Diese Geräte, wie in den vorangegangenen berichtet arbeitet 13,14, zeigen eine hohe Biokompatibilität sowie mechanischen und physikalisch – chemische Eigenschaften, die denen von vielen lebenden Geweben und in thixotropen Natur ähneln. Außerdem bleiben sie in situ lokalisiert in der Zone der Injektion.
In dieser Arbeit PAA Carboxylgruppen mit einem Alkin – Einheit (1) modifiziert und eine RGD-Azid – Verbindung synthetisiert wird , die Reaktivität des Tripeptids Endgruppe NH 2 mit einer vorbereiteten chemische Verbindung mit der Struktur zu nutzen (CH 2) n – N 3 (<strong> Abbildung 2). Anschließend reagiert das modifizierte PAA mit dem RGD-Azid – Derivat durch CuAAC Klick – Reaktion 15-17 (Abbildung 3). Die Verwendung eines Kupfer (I) -Katalysator führt zu wesentlichen Verbesserungen in sowohl die Reaktionsgeschwindigkeit und die Regioselektivität. Die CuAAC Reaktion wird in der organischen Synthese und in der Polymerwissenschaft weit verbreitet. Es verbindet einen hohen Wirkungsgrad und eine hohe Toleranz gegenüber den funktionellen Gruppen, und es ist unabhängig von der Verwendung von organischen Lösungsmitteln. Eine hohe Selektivität, eine schnelle Reaktionszeit und eine einfache Reinigungsverfahren ermöglichen die Gewinnung von Sternpolymeren, Blockcopolymere oder Ketten gewünschten Einheiten 18 Pfropfen. Dieser Klick-Strategie ermöglicht es, Polymere nach der Polymerisation zu modifizieren, um die physikalisch-chemischen Eigenschaften nach der endgültigen biochemischen Anwendung anpassen. Die CuAAC experimentellen Bedingungen sind leicht reproduzierbar (die Reaktion ist unempfindlich gegen Wasser, während Kupfer Oxidation minimal auftreten kann), und die Art dergebildet Triazol sorgt für Stabilität des Produkts. Die Verwendung von Kupfermetall kann ein kritischer Punkt, aufgrund seiner potentiellen toxischen Wirkung gegenüber Zellen und in der biologischen Mikroumgebung in Betracht gezogen werden, aber der Dialyse wird als Reinigungsverfahren verwendet, um die vollständige Entfernung von katalytischen Rückständen ermöglichen. Schließlich PAA modifizierte RGD in Hydrogel – Synthese (4) und die physikalisch – chemischen Eigenschaften der resultierenden Netzwerken verwendet wird untersucht, um die potentielle Funktionalität dieser Systeme als Zellen oder Drogen Träger zu überprüfen.
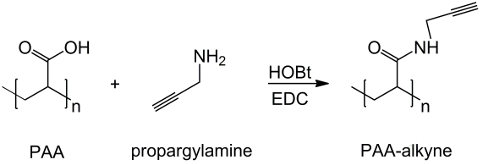
Abbildung 1: PAA modifizierte Alkin Synthese ein Schema PAA Funktionalisierung mit Alkin – Gruppe;. "n" gibt die Monomere mit Carboxylgruppe mit Propargylamin reagieren. Bitte klicken Sie hier um zu seheneine größere Version dieser Figur.
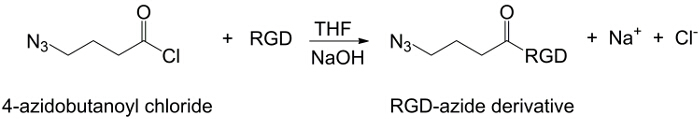
Abbildung 2:.. RGD-Azid – Synthese Die Synthese von RGD-Azid – Derivat Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
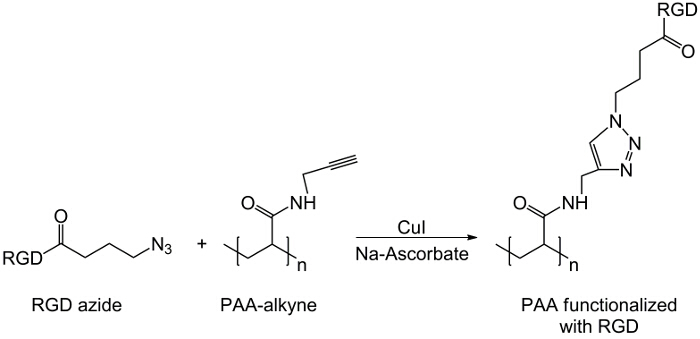
Abbildung 3: Klicken Sie auf Reaktionsschema der Klick – Reaktion zwischen RGD-Azid – Derivat und Alkin-PAA.. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
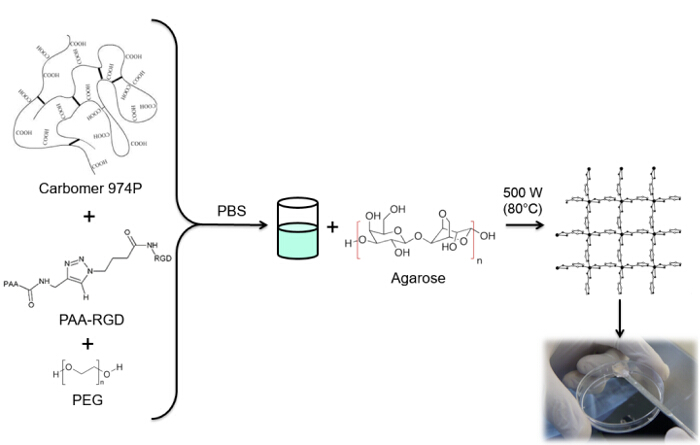
Abbildung 4: Hydrogele synthesis. RGD funktionalisierten Hydrogel – Syntheseverfahren. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
The PAA post-polymerization modification with alkyne moieties and the RGD functionalization with the azide group guarantee the formation of a stable bond between the polymer and the peptide. Indeed, triazole serves as a rigid linking unit among the carbon atoms, attached to the 1,4 positions of the 1,2,3-triazole ring and it cannot be cleaved hydrolytically or otherwise. In addition, triazole is extremely difficult to oxidize and reduce, unlike other cyclic structures such as benzenoids and related aromatic heterocycles<…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Autoren möchte Prof. Maurizio Masi für eine fruchtbare Diskussion und Fräulein Chiara Allegretti für Lektur danken. Autoren Forschung wird von Bando Giovani Ricercatori 2010 (Ministero della Salute GR-2010- 2312573) unterstützt.
Materials
| Poly(acrylic acid) solution average Mw ~ 100,000, 35 wt % in H2O | Sigma Aldrich | 523925 | CAS 9003-01-4 |
| Poly(ethylene glycol) 2,000 | Sigma Aldrich | 84797 | CAS 25322-68-3 |
| Carbomeer 974P | Fagron | 1387083 | |
| Agarose | Invitrogen Corp. | 16500-500 | UltraPure Agarose |
| RGD peptide | abcam | ab142698 | |
| 4-azidobutanoic acid | Aurum Pharmatech | Z-2421 | CAS 54447-68-6 |
| Oxalyl chloride | Sigma Aldrich | O8801 | CAS 79-37-8 |
| Propargylamine hydrochloride 95% | Sigma Aldrich | P50919 | CAS 15430-52-1 |
| Copper(I) iodide | Sigma Aldrich | 3140 | CAS 7681-65-4 |
| Sodium ascorbate | Sigma Aldrich | Y0000039 | CAS 134-03-2 |
| Phosphate buffered saline | Sigma Aldrich | P4417 | |
| Dialysis Membrane | Spectrum Laboratories, Inc. | 132725 | Spectra/Por 3 Dialysis Membrane Standard RC Tubing MWCO: 3,5 kD |
Riferimenti
- Slaughter, B. V., Khurshid, S. S., Fisher, O. Z., Khademhosseini, A., Peppas, N. A. Hydrogels in Regenerative Medicine. Adv. Mater. 21 (32-33), 3307-3329 (2009).
- Rossi, F., Perale, G., Papa, S., Forloni, G., Veglianese, P. Current options for drug delivery to the spinal cord. Expert Opin. Drug Deliv. 10 (3), 385-396 (2013).
- Huebsch, N., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Mothe, A. J., Tam, R. Y., Zahir, T., Tator, C. H., Shoichet, M. S. Repair of the injured spinal cord by transplantation of neural stem cells in a hyaluronan-based hydrogel. Biomaterials. 34 (15), 3775-3783 (2013).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat. Mater. 12 (5), 458-465 (2013).
- Ashley, G. W., Henise, J., Reid, R., Santi, D. V. Hydrogel drug delivery system with predictable and tunable drug release and degradation rates. Proc. Natl. Acad. Sci. U S A. 110 (6), 2318-2323 (2013).
- Rossi, F., van Griensven, M. Polymer Functionalization as a Powerful Tool to Improve Scaffold Performances. Tissue Eng. Part A. 20 (15-16), 2043-2051 (2014).
- Gould, S. T., Darling, N. J., Anseth, K. S. Small peptide functionalized thiol-ene hydrogels as culture substrates for understanding valvular interstitial cell activation and de novo tissue deposition. Acta Biomater. 8 (9), 3201-3209 (2012).
- Azagarsamy, M. A., Anseth, K. S. Wavelength-Controlled Photocleavage for the Orthogonal and Sequential Release of Multiple Proteins. Angew. Chem. Int. Edit. 52 (51), 13803-13807 (2013).
- Larrañeta, E., et al. Microwave-Assisted Preparation of Hydrogel-Forming Microneedle Arrays for Transdermal Drug Delivery Applications. Macromol. Mater. Eng. 300 (6), 586-595 (2015).
- Cook, J. P., Goodall, G. W., Khutoryanskaya, O. V., Khutoryanskiy, V. V. Microwave-Assisted Hydrogel Synthesis: A New Method for Crosslinking Polymers in Aqueous Solutions. Macromol. Rapid Comm. 33 (4), 332-336 (2012).
- Perale, G., et al. Multiple drug delivery hydrogel system for spinal cord injury repair strategies. J. Control. Release. 159 (2), 271-280 (2012).
- Rossi, F., Perale, G., Storti, G., Masi, M. A Library of Tunable Agarose Carbomer-Based Hydrogels for Tissue Engineering Applications: The Role of Cross-Linkers. J. Appl. Polym. Sci. 123 (4), 2211-2221 (2012).
- Frith, J. E., et al. An injectable hydrogel incorporating mesenchymal precursor cells and pentosan polysulphate for intervertebral disc regeneration. Biomaterials. 34 (37), 9430-9440 (2013).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click chemistry: Diverse chemical function from a few good reactions. Angew. Chem. Int. Edit. 40 (11), (2001).
- Sacchetti, A., Mauri, E., Sani, M., Masi, M., Rossi, F. Microwave-assisted synthesis and click chemistry as simple and efficient strategy for RGD functionalized hydrogels. Tetrahedron Lett. 55 (50), 6817-6820 (2014).
- Ossipov, D. A., Hilborn, J. Poly(vinyl alcohol)-based hydrogels formed by "click chemistry". Macromolecules. 39 (5), 1709-1718 (2006).
- Truong, V., Blakey, I., Whittaker, A. K. Hydrophilic and Amphiphilic Polyethylene Glycol-Based Hydrogels with Tunable Degradability Prepared by "Click" Chemistry. Biomacromolecules. 13 (12), 4012-4021 (2012).
- Hou, R. Z., et al. New synthetic route for RGD tripeptide. Prep. Biochem. Biotechnol. 36 (3), 243-252 (2006).
- Rossi, F., Chatzistavrou, X., Perale, G., Boccaccini, A. R. Synthesis and Degradation of Agar-Carbomer Based Hydrogels for Tissue Engineering Applications. J. Appl. Polym. Sci. 123 (1), 398-408 (2012).
- Mauri, E., Rossi, F., Sacchetti, A. Tunable drug delivery using chemoselective functionalization of hydrogels. Mater. Sci. Eng. C. 61, 851-857 (2016).
- Joaquin, A., Peppas, N. A., Zoldan, J. Hydrogel Polymer Library for Developing Induced Pluripotent Stem Cell Derived Cardiac Patches. Tissue Eng. Part A. 20, S55-S55 (2014).
- Rossi, F., et al. Tunable hydrogel-Nanoparticles release system for sustained combination therapies in the spinal cord. Colloids Surf. B Biointerfaces. 108, 169-177 (2013).
- Kolb, H. C., Sharpless, K. B. The growing impact of click chemistry on drug discovery. Drug Discov. Today. 8 (24), 1128-1137 (2003).
- Ossipov, D. A., Yang, X., Varghese, O., Kootala, S., Hilborn, J. Modular approach to functional hyaluronic acid hydrogels using orthogonal chemical reactions. Chem. Commun. 46 (44), 8368-8370 (2010).
- Anderson, S. B., Lin, C. C., Kuntzler, D. V., Anseth, K. S. The performance of human mesenchymal stem cells encapsulated in cell-degradable polymer-peptide hydrogels. Biomaterials. 32 (14), 3564-3574 (2011).
- Caron, I., et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 75, 135-147 (2016).
- Lee, J. W., Kim, H., Lee, K. Y. Effect of spacer arm length between adhesion ligand and alginate hydrogel on stem cell differentiation. Carbohyd. Polym. 139, 82-89 (2016).
- Liu, Y., Fan, Z., Wang, Y., Yu, L. Controlled Release of Low Molecular Protein Insulin-like Growth Factor-1 through Self-Assembling Peptide Hydrogel with Biotin Sandwich Approach. J.Biomed. Eng. 32 (2), 387-392 (2015).

